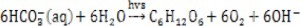藻種培養問題
三角褐指藻變綠色,後來又變成茶褐色可能的原因是什麽
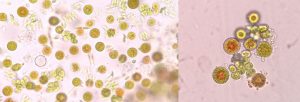
西安漢寶李朝義總經理在開發矽藻濃縮液産品的時候,前階段培養的三角褐指藻,一瓶濃縮避光保存,兩個多月後幾乎變成了黃綠色,接近綠色了,剛放在窗台上曬了幾小時,很快就變成茶褐色了,這是什麽原因?
華南理工大學魏教授:三角褐指藻中岩藻黃素-葉綠素-捕光蛋白是三位一體的FCP。避光保存下捕光色素、光合色素降解,岩藻黃素降解比葉綠素更快,故顯黃綠色。見光後開始捕光和光合作用,岩藻黃素和葉綠素快速合成,分子摩爾比相當,但前者顔色更深,遮擋了葉綠素顔色,故顯棕色。
深圳大學王教授:這快速變色有沒有可能是色素的集中和分散,血紅裸藻可以在8分鍾内變色,從綠色變血紅色,發現是色素的集中和分散。類似變色龍.
華南理工大學魏教授:裸藻是原生功物,進化程度更高,可能代謝調節速度更快。加上細胞體積更大,色素分散可能性更大。但矽藻、金藻中更大可能是合成與分解的調控,速度更慢些。
日常生物中發現甲藻和矽藻變綠,鏡檢卻很幹淨,可能并不是藻種被污染而是光照或者藻種代謝出現問題,紫外譜段的生理效應,對于生物都那麽重要。可以嘗試用紫外燈照射刺激一下。日常用三基色激發的熒光燈在藻類培養中有時候效果比強光照LED更有效也可能是激發光有少量的UV紫外波段。
控制哪些條件能維持微囊藻群落形态
控制哪些條件能把采集的自然水樣中的微囊藻群落形态在轉接過程中維持下來呢?高濃度鈣,不要攪拌,低溫
如何分散培養成絮狀矽藻細胞
矽藻細胞在經過一段時間培養後會變成絮狀,一般可以通過攪拌,通氣,或者調節pH從高到中性就可以變成單細胞狀态。
餌料金藻被污染怎麽處理?
發現金藻有污染可以在傍晚用10ppm有效氯殺滅,1小時後用硫代硫酸鈉中和餘氯,第二天大部分可以恢複活力,也可以投喂,但隻能操作一次
微藻半固态保種是什麽意思
目前微藻常見保種方式有固态斜面和液态藻液保存。半固态保存就是在一個三角燒瓶裏面底部用含培養基的瓊脂加上藻液,上面是培養基的一種保存方式。半固态保種适合用于長期保種,幾個月更換一次培養基和複壯。轉接出來比純固态容易 不過沒純液體快 優點是細胞增殖慢 遺傳相對穩定 種源衰亡退化慢。缺點是成本比純液态高,比較容易染菌 另外從保種到活化出來用需要一段時間。
小球藻和球等鞭金藻如何濃縮,濃縮液怎麽保存效果好?
1、小球藻的濃縮以(80±5)mg·kg-1的明礬液及4%的石灰水效果最好;球等鞭金藻的濃縮以(100±10)mg·kg-1的明礬液及6%的石灰水效果最好。
保存方法以加入保護劑甘油并置于-30℃冰箱中效果最好,小球藻和球等鞭金藻的存活率分别爲95%和93%。低溫保存前後,藻的高度不飽和脂肪酸(HUFA)的含量變化不明顯,用濃縮液投喂中國對蝦和輪蟲的效果與普通藻無顯著差異。
2、項文钰等将小球藻和蛋白核小球藻都分别加入10%、20%、30%的DMSO,以及20%、35%和50%的甘油,保存在-20℃、-75℃和-196℃的液氮中,再各取一些不加任何防凍劑保存在20℃的培養箱裏。3個月後取出培養,觀察顔色變化并測量其中的葉綠素含量,結果表明:濃縮的藻液可以在20℃下長期保存;小球藻濃縮藻液添加20%的甘油在各種不同的溫度下保存效果都很好,其次是10%的DMSO;而衣藻則加入10%的DMSO在各種溫度下保存都較好,加入20%的甘油,在液氮中保存的效果最好。濃度大于10%的DMSO和大于20%的甘油對微藻細胞的保藏效果不佳。
培養小球藻中亞硝酸鹽含量較高,是什麽原因導緻的
首先要考慮培養條件是否合适(如溫度低),氨氮高加上如果磷酸鹽不足,營養不均衡,導緻藻類光合作用弱,導緻底部氧少,從而加劇亞硝酸鹽的積累,惡性循環,其次考慮檢測方法是否有鹽度幹擾等,再次,硝态氮使用過量也可引起亞硝酸含量增加。
f/2培養基配好後需要調pH嗎
一般淡水藻的培養基配置好之後要調pH,比如TAP等,但是海水藻培養基一般不調pH,除非配錯了,自然海水的pH在8-8.5之間,f/2用海水做溶劑配置好之後不需要專門調pH
擴培的藻種長不好怎麽辦
網友回複:在原水、培養基和溫度都沒問題的情況下,我以前養過微囊藻,藍藻,藻濃度比較低的時候,光太強會死的所以接種我都接的濃度相對稍微高一點,或者亮度比較低,有時候還用報紙擋一下。
雨生紅球藻什麽情況會變白
室外反應器的雨生紅球藻紅細胞漂白很多時候出現在夜間,基本都是個别細胞白了不會全白,這種完整的透明細胞形态可以維持10天以上,光太強,光氧化,類胡蘿蔔素分解了還可以理解,最奇怪的是葉綠素也漂白沒了
1、強光誘導下,不補充二氧化碳會變白的;
2、晚上光合作用停止,溫度的突然變化也會造成細胞漂白;
3、pH變化也會使得細胞變白;
4、鹽誘導過程,濃度不均勻也會造成細胞變白
培養卵囊藻,如何正确使用磷肥?
培養卵囊藻使用磷肥注意,如果使用磷肥品質不好,就會導緻藻類生長慢。培養卵囊藻尿素和磷酸氫二鉀比例是10:1。如果使用過磷酸鈣,因溶解度差,磷含量低,用量要增加2到3倍,也就是尿素和過磷酸鈣比例爲10:2-3。
注意磷肥質量。
磷酸氫二鉀假的多,特别是小塑料袋包裝,大多是假貨。過磷酸鈣要使用白色粉沫,能用于水的産品。使用大廠家的産品。
大規模培養小球藻,有哪些方式?
當前國際上大規模培養小球藻的主要方式,可以概括爲:密閉無菌培養,開放半無菌培養,開放藻菌混養。
東海原甲藻和海洋原甲藻的形态區别
東海原甲藻是倒批針心形,海洋原甲藻是心形 頂端有刺
TAP培養基顔色變化的原因
TAP培養基的配置說明中關于Hutner’s trace elements中的初始配置好是綠色 靜置一陣子 每天搖動促進溶解 顔色變紫色 曝氣 過濾之後 紫紅褐色 隻要靜置不産生沉澱 都可以用,如果配置的顔色變化過程和說明不同順序或者産生沉澱則說明試劑出錯。
TAP培養基中冰醋酸的使用
TAP培養基的濃縮液都會配有一瓶冰醋酸,配置工作液的時候,請先加入按比例加入其他幾種母液成分,然後用pH計攪拌,用冰醋酸滴定到pH中性,然後再高溫高壓滅菌使用.冰醋酸不是用來按比例添加的。
L1-Si (或者 f/2 –Si) 是什麽意思?
指的是我們的L1和F / 2不含矽酸鹽培養基。矽酸鹽可以引起介質中的沉澱,從而抑制某些菌株的生長。矽酸鹽隻需要培養具有二氧化矽要求的矽藻或其他生物。
培養藻種在使用購買的光語培養基的時候改變其中的配方嗎?
可以。請放心使用我們的培養基。你可能會減少不必要的成分,如養矽藻不需要矽酸鹽。你可能會改變實驗目的增加額外的成分。您還可能希望降低鹽度讓培養基能生長一些細菌。但是,我們建議如果你不确定配方的時候。我們提供的培養基是最佳的。
培養基裏面用碳酸氫铵經濟還是尿素便宜?
在傳統大規模培養中氮源一般是用碳酸氫铵或者尿素的,從經濟角度來說,碳酸氫铵和尿素的含氮量比例是1:2.7。
如果碳酸氫铵的價格是800元/噸,那麽尿素低于2160元/噸,就是尿素劃算。
加什麽試劑可以讓鹽藻暫時靜止(不運動但不失活,目的是爲了拍照)
甘油或者低熔點瓊脂
如何測定藻細胞油脂含量
對于已經分離了的微藻也可以通過96孔闆篩選方法進行快速高通量測定其各種類微藻的油脂含量。通常的做法就是将待測定的微藻分别用96孔闆培養240μl,每個樣品至少做三個複孔。爲了避免邊緣效應,96孔闆的邊沿的微孔應該不加入樣品而加入相應的培養基,處理好的96孔闆放置于光照培養箱中培養。最後在一定時期内加入1μl濃度爲0.5mg/ml的尼羅紅染液進行染色10min後在熒光酶聯免疫酶标儀中測定熒光強度。尼羅紅染色法在一些細胞壁比較薄,柔軟的種類中得到很好的應用,如黃藻綱、金藻綱、矽藻綱等。但是對于部分藻細胞壁較厚較嚴密的微藻類,簡單的尼羅紅染色法所測能檢測到的熒光信号強度并不理想,如綠藻屬。這時,如在染色時加入微量的DMSO溶液,可使尼羅紅更容易通過藻細胞壁,從而有效增強熒光信号的強度,擴大了尼羅紅熒光染色在篩選高産油脂微藻中的應用範圍。林義等人将尼羅紅染液直接加入到分離培養基,對358株産油酵母進行篩選,在280-300nm紫外光照射下,辨别高産油菌株,并獲得産油量高達62.9%的菌株。
如何分離純化微藻細胞
離心分離:離心分離法利用微藻的離心沉降系數不同而将其分離,一般采用1000-3000轉速即可,太高轉速雖能将微藻分離,但是高轉速容易損傷藻細胞,不易養活,而太低的轉速可沒能很好的分離藻細胞。一般情況下,在使用其他分離方法之前也可以使用離心分離法将部分雜質去掉,然後再做相應的分離。在無菌操作之下重複用無菌水進行離心分離可以達到純化作用,而達到純化作用至少須要重複離心20次。
劃線分離:與傳統的微生物劃線分離一樣,利用接種環沾取微藻懸浮液,然後在瓊脂平闆上劃線。最後在人工氣候箱中培養一段時間,一般至少須要兩周的時間才能長出微藻藻落,再從單個微藻藻落中挑取微藻至于幹淨滅菌的含有相同成分的液體培養基進行培養。若已得純種微藻則可以擴大培養。
稀釋分離:特定濃度的微藻懸浮液用培養基或者滅菌的蒸餾水進行不斷的稀釋,直到每一滴液滴中隻有一個微藻時即停止。稀釋好的微藻懸浮液可以滴在幹淨的載璃片上,置于顯微鏡下觀察,若視野中即每一滴懸浮液隻有一個藻細胞則将其移入事先準備好的培養液中培養,也可以将稀釋好的微藻懸浮液直接按照每孔一滴加入到96孔闆中培養,然後挑取隻有單個微藻繁殖(同一微孔内隻有一種微藻)而來的微孔進行擴大培養。
微吸管分離法:微吸管分離法或許是獲得單細胞藻類最常用并且最實用的方法了,該方法适用于藻細胞較大的藻類,但微吸管法對試驗儀器的要求也相對較高。實驗前須将微吸管或者微璃璃點樣管在酒精燈火焰處将微觀燒軟,然後迅速将微管移離火焰并迅速将其拉長,用醫學鉗子在合适孔徑處将其均勻鉗斷,獲得圓滑的微吸管口,并且微吸管口的孔徑至少要比所吸取的藻細胞大兩倍以上,在吸取藻細胞時須要緩慢,由于流體切變力,過快的吸取速度會導緻藻細胞損傷,微吸管口也不可太大,太大就難以吸取單個的目的微藻細胞。毛細管制好之後,将其與2μl、5μl、10μl或者100μl的槍頭連接,最後與移液槍連接即可。在使用微吸管分離的時候,使用普通的光學顯微鏡即可,由于其載物台較低,因此其操作也比較方便,特别是對于新手所遇到的手抖問題。在用微吸管法分離法吸取細胞時,往往須要進行多次分離,自于毛細管作用,須要先将毛細管管頭至于滅菌的蒸餾水中,将毛細管浸濕以減少毛細管作用,然後利用已浸濕毛細管在樣液中吸取單個微藻細胞,若吸取不止一個微藻細胞,則将吸取液吹打到滅菌幹淨的蒸餾水中再次重複操作,重複多次就可以得到單個的純藻細胞。
96孔闆法:96孔闆在微藻快速分離篩選方面起到重要作用。目前常用的方法是将待分離的水樣進行稀釋,直到每滴大概含有一個微藻細胞爲止,然後将稀釋好的藻液按照每孔一滴加入到含有分離培養基的96孔闆中,每孔大概250μl,培養基可以是液體的也可以是固體。置于預先設置好培養條件的人工培養箱中富集培養。如此,在一定的天數之後,某些96孔中所長出來的微藻就有可能是純種微藻。
卵囊藻怎麽培養
卵囊藻一般都是淡水種,可以在馴化後在低鹽度海水中使用,千分之十五以下。但是擴種培養需要在淡水進行,一般采用bg11或者se培養基培養,溫度在18-25攝氏度,光照周期14:10或者12:12,光照強度3000-6000lux。
光語提供的藻種密度是多少
我們提供的藻種隻保證生物活性,可擴培,不承諾高密度生物量,高密度生長指數期的藻種不利于保種和運輸,接種後很容易進入衰退期。
購買藻種提供培養微藻培訓嗎?
客戶在光語生物科技有限公司購買藻種,我們會提供一份藻種擴培指引和藻類培養基配方,生長條件以及常見培養遇到的問題處理以及大批量培養的方法等。我們無法提供一對一的零基礎培訓和指導。如需相關培訓請聯系提供相關課程的機構,例如中國科學院水生生物研究所,National Center for Marine Algae and Microbiota (NCMA)等單位
一般加速微藻生長的氮源采用哪些成分?
在實驗室和發酵工業生産中,我們常常以铵鹽、硝酸鹽、牛肉膏、蛋白胨、酵母膏、魚粉、血粉、蟬蛹粉、豆餅粉、花生餅粉作爲微生物的氮源。不同的微藻對于有機氮源的代謝機制也不同,所以一般實驗都是要先做平行實驗看看到底需要哪種有機氮源。如果覺得平行實驗分析周期太長,索性 就按照NPM配方加入裏面的氮源組分也可培養起來。
培養藻種的海水來源
我們的海水來自樂清灣海水稀釋或者溶解粗粒海鹽并經過高溫高壓滅菌。樂清灣水質肥沃,餌料生物豐富,十分利于海水養殖,是浙江省蛏、蚶、牡蛎三大貝類的養殖基地和苗種基地。貝類育苗的首選餌料就是海洋藻類。
你們的藻種保證無菌嗎?!
我們的液體藻種不承諾無菌。
我們藻種隻保證藻細胞的活性沒有雜藻和原生動物,我們的保存環境有空調房和十萬級無塵室。所有的操作是在嚴格的無菌操作台進行。所有藻種的容器和培養基都經過高溫高壓滅菌
我們的無塵室藻種出廠都會附帶一個甲醛或者魯格氏固定樣以便客戶觀察藻種發出時狀态。
但是對于在運輸和包裝過程出現的細菌污染以及客戶的操作無可控制,因此如需完全無菌的藻種請購買我們的藻種固體平闆或者自行劃線分離。
光語藻種和培養基發貨地在哪裏
我們的藻種根據淡水藻,海水藻,赤潮藻(嚴格控制)的不同以及對水質的要求存放在上海、浙江、福建三個地方。
培養基一般在浙江或者福建發出。
雨生紅球藻培養液選擇
雨生紅球藻異養的碳源是什麽?
一般小球藻異養發酵采用的是葡萄糖作爲碳源,雨生紅球藻(haematococcus pluvialis)缺少利用葡萄糖的機制,一般是采用乙酸鈉(醋酸鈉,sodium acetate)作爲碳源
什麽是軟骨藻酸?
軟骨藻酸(Domoic acid),非蛋白氨基酸,是由長鏈羽狀矽藻代謝産生的一種強烈的神經毒性物質,能導緻短期記憶功能的長久性損害。
自從1987年加拿大中毒事件後開始被認識。毒性作用機制可能爲:通過谷氨酸與内源性神經遞質協同,胞内鈣離子超載使信号轉導紊亂;代謝紊亂使神經元不具有足夠的能量維持正常的靜息膜電化學梯度。
軟骨藻酸
軟骨藻酸(Domoic acid,DA)是一種天然神經性氨基酸,從污染貝類中分離、提取獲得或拟菱形藻+尿素可以産生大量的軟骨藻酸。興奮性脯氨酸衍生物和神經毒素,是浮遊植物代謝的産物,可以在被藻類污染的海洋食物特别是貝類中檢測到,其結構與紅藻氨酸和谷氨酸相似,是紅藻氨酸受體的興奮劑。主要由某些拟菱形藻屬和菱形藻屬的海洋矽藻産生,人們食用毒化的貝類,可引起記憶喪失、眩暈、昏迷甚至死亡等症狀,根據這種毒素的中毒特征,被命名爲記憶喪失性貝毒(Amnesic Shellfish Poisoning,ASP)。
軟骨藻酸可以幹擾哺乳動物及人的神經信号傳遞。軟骨藻酸可以與谷氨酸神經遞質的受體相結合,它的結合效率比谷氨酸高得多。這種結合過程使神經細胞産生錯誤指令,誤認爲谷氨酸濃度過剩,而将其排除出去,直到所有的谷氨酸都被消耗完,以緻使神經細胞死亡。它的一種結構類似物,海人草酸也是從紅藻如Digenea simplex,Palmeria plamata,Centrocetos clvulatum中發現的,但是,它對神經受體的結合力沒有軟骨藻酸高。由此開發成功了非常靈敏的軟骨藻酸測定方法。先将海人草酸進行放射性标記,并使其與神經受體結合。當出現軟骨藻酸時,海人草酸就從受體上釋放下來,通過測定遊離的放射性強度,就可以測定軟骨藻酸的濃度。軟骨藻酸的基本骨架是谷氨酸,其側鏈是單萜,即異戊二烯的二聚體。其基本的生物合成途徑是谷氨酸與3,4-二甲基辛二烯-2,6-焦磷酸(Geranyl py-rophosphate)發生環化反應。
軟骨藻酸可影響人和動物的消化道、心血管系統、中樞神經系統,它對與内髒功能有關的腦幹區域具有興奮作用,而對與記憶有關的腦區域具有明顯的神經毒性作用。此外,也會損害脊髓、視網膜。研究發現,貝組織中軟骨藻酸含量達到40mg/kg時可引起食用者中毒,150mg/kg時有緻死危險,人類通過進食可耐受的最大限量爲20mg/kg,加拿大首先制定了安全限量标準爲20μg/g貝肉,歐洲、日本也相繼将該種毒素列爲貝類常規檢測項目。
萊茵衣藻cc3960培養注意事項
cc3960是萊茵衣藻的突變體,在培養的時候除了添加6mmol/L銅離子之外還需要添加精氨酸(Arg)才能成活
關于底栖矽藻培養
矽藻當中底栖類的培養是一個很頭疼的問題,由于分泌的膠質物有粘性,藻會黏到一塊去,容易産生絮狀沉底,搖晃一下好一點,不一會就又全部沉底了,使得生物量很難漲上去。
一般我們建議客戶将矽藻上清取出後擴培 ,這裏面的細胞大都沒有黏在一起,都還是獨立個體,在新的培養基裏面培養,定期的攪拌,使得整個水體的藻類都分布均勻,産生絮狀沉底的現象大大減少。
矽藻生長周期一般是3-4天就要加培養基擴培了,否則産生膠質物的濃度就會将藻粘在一起。
f/2濃縮培養液使用要注意哪些問題
上海光語生物科技有限公司爲廣大客戶提供的f/2濃縮培養液在使用過程中應該注意哪些問題?
培養液的配置需要在超淨台上操作,這樣子一般不會染菌。隻要每次吸取都更換滅過菌的槍頭。濃縮液可以加到海水裏面高壓滅菌,不過有文獻說維生素高溫會降解,所以一般是維生素滅菌之後添加。如此繁瑣 還不如都等使用前添加。當然,如果使用中發現母液有沉澱,一般是要重新抽濾。 除了維生素和矽酸鈉需要用一次性注射器和針孔濾膜過濾 其他3種都是先抽濾後高壓滅菌。我們多次測試:一般隻要使用過程中做到盡量無菌和無外源污染以及槍頭交叉污染,至少1年之内不會染菌或者沉澱。
配置海水消毒後按比例添加f/2母液或者按比例添加母液後消毒兩種方法我們做過比對,影響不明顯。實際上藻株隻要有硝酸鈉等幾種大組分就能培養,但是我們都添加另外幾種,至于細胞對微量元素的吸收情況,做針對性研究的不多,大家都是根據細胞内組分推斷細胞利用的營養成分。
藻類保存需要添加哪些元素
藻類長期保存是一件很頭疼的問題,一般我們添加一些N元素,如尿素,氯化铵等,C元素,碳酸氫鈉,二氧化碳等,一些抑菌劑比如磷酸三鉀等
“11/5 o’clock direction”是什麽意思?
嚴先生答:
哪些藻會發光
夜光藻(學名:Noctiluca scintillans),俗稱海耀[1],也稱夜光蟲,爲一種在海中生存的非寄生甲藻,能作生物發光。這種藻類之所以能發光,是因爲其體内數以千計的球狀胞器中,具有螢光素-螢光素酶,這些胞器就像微型的電源供應器,讓夜光藻在感受到周遭環境的變化時發出螢光。
夜光藻爲異養有機體,它能夠吞噬,會以浮遊生物、矽藻、甲藻、細菌,甚至魚卵爲食,有文獻指出,矽藻爲夜光藻最愛的食物;它也能以光合作用生存[2]。實驗室條件下我們一般都是投喂扁藻。
藻類本身并無毒性,但其吞食浮遊生物之後,體内會留下大量的氨,這些氨會被藻類排洩出來至附近水域,有些特殊藻類則能将之轉化爲神經毒素(例如亞曆山大藻),造成該水域中的生物死亡。
夜光藻一般保存期很短就1-2個月,而且隻有夏季水溫高的時候才能篩選到。
塔瑪亞曆山大藻是可以發光的,但是他不能像夜光藻那麽亮。隻有養的很好的時候才會發光!
三角褐指藻和小新月菱形藻的區别
矽藻生活習性方面的知識
源自http://tolweb.org/Diatoms/21810
http://earthobservatory.nasa.gov/Features/Phytoplankton/
Introduction
The diatoms are one of the largest and ecologically most significant groups of organisms on Earth. They are also one of the easiest to recognize, because of their unique cell structure, silicified cell wall and life cycle. They occur almost everywhere that is adequately lit (because most species need light for photosynthesis) and wet – in oceans, lakes and rivers; marshes, fens and bogs; damp moss and rock faces; even on the feathers of some diving birds. Some have been captured by other organisms and live as endosymbionts, e.g. in dinoflagellates and foraminifera. Because of their abundance in marine plankton, especially in nutrient-rich areas of the world’s oceans, diatoms probably account for as much as 20% of global photosynthetic fixation of carbon (~ 20 Pg carbon fixed per year: Mann 1999), which is more than all the world’s tropical rainforests.
 Hydrosera. © David G. Mann. This image comes from the Professor Frank Round Image Archive at the Royal Botanic Garden Edinburgh
Hydrosera. © David G. Mann. This image comes from the Professor Frank Round Image Archive at the Royal Botanic Garden Edinburgh
Diatom cells have regular geometrical shapes. In a mathematical sense, they are always ‘closed generalized cylinders’ and they are usually straight (‘right’) but the cross section of the cylinder can vary from circular to elliptical to spicular to complex lobed shapes like the Hydrosera cell shown above. The shape is maintained faithfully, whatever the environmental conditions, because the cell wall contains a large proportion of hard, brittle silica, which is partially hydrated [(SiO2)m.nH2O] and non-crystalline. Basically, diatoms live in glass boxes. The silica shell of the diatom is called the ‘frustule’ and is made of two halves, each in turn composed of several different pieces. Hydrosera frustules, like those of all other diatoms, are perforated by many small holes, which allow water, dissolved material and solids (gases, inorganic nutrients, and organic substrates and secretions) to pass in or out.
Left: Living diatoms and other algae from a freshwater loch in Scotland. Right: False-colour picture of a subfossil assemblage from a muddy deposit a few metres below the surface of a mire in SW Scotland. © 2008 David G. Mann
The silica of the diatom cell wall is resistant to decay, although it will begin to dissolve once its organic coating has been stripped off. Once incorporated into silica-rich sediments, however, frustules may survive for hundreds to millions of years and can be used to monitor changes in freshwater or marine environments. The left-hand picture above shows a spread of living diatoms and other algae from a freshwater loch in Scotland. Each cell contains one to several brownish chloroplasts. Shown in the right-hand (false-colour) picture is a subfossil assemblage from a muddy deposit a few metres below the surface of a mire in SW Scotland. Here, all the cells are empty – only the cell walls remain; indeed, in many cases the cell walls have fallen apart into their component pieces. But it is still possible to identify them, because the walls retain their shape and pattern. Consequently, if the ecologies of the species are known, then the fossil assemblage can be used to estimate what conditions were like when it was formed. In the assemblage illustrated there are both planktonic species (the circular Cyclotella valves) and benthic species, which have become mixed together after death.
Life cycle series of Navicula reinhardtii valves. © 2008 David G. Mann
Because of the construction of the silica frustule and the way in which cells divide, average cell size declines during the life cycles of most diatoms. The shape often changes too, as in the series of Navicula reinhardtii valves shown. It can take a long time for cells to decline to their smallest size – often several years in nature – but sooner or later there is an abrupt restitution of size, taking a few days, involving formation of a special cell, called an auxospore. This behaviour is unique.
Variation in shape and size during the life cycle causes major problems for people trying to identify diatom species and also for taxonomists, if only a few dead specimens are available for study. If diatoms ‘miss’ the chance to form auxospores (for example, if suitable mates are not available, or if environmental conditions are unsuitable), the cells continue to divide, getting smaller and smaller until they die.
Characteristics
Diatoms share several characteristics with some or all other heterokont algae, including (see also van den Hoek et al. 1995):
- plastids that are enclosed by four membranes. The inner two are homologous with the two membranes surrounding the plastids of Rhodophyta, Chlorophyta and Glaucophyta. The outer two, often referred to as ‘chloroplast endoplasmic reticulum’ reflect the origin of the heterokontophyte plastid as a secondary endosymbiont, related to extant Rhodophyta.
- between the outer and inner chloroplast membranes, there is often a network of anastomosing tubules called the periplastidial reticulum.
- grouping of the thylakoids into stacks of three (lamellae) within the plastid.
- presence of a girdle lamella beneath the plastid membranes, surrounding all the other lamellae.
- chlorophylls a and c and fucoxanthin as the major light-harvesting pigments for photosynthesis.
- chloroplast DNA usually concentrated within a ring-shaped nucleoid at the periphery of the plastid (but there are exceptions in some diatoms!)
- a β-1,3-linked glucan as the main reserve polysaccharide.
- possession of special tripartite stiff hairs (‘mastigonemes’) on a flagellum.
- mitochondrial inner membrane developed into tubular invaginations.
Diatoms share with the bolidophytes a unique 2 amino-acid insertion in the large subunit of Rubisco.
The characteristics of diatoms are that:
- all species are unicellular or colonial coccoid algae. None are free-living flagellates.
- the only flagellate cells produced are the male gametes (= sperm, spermatozoids) of ‘centric’ diatoms. These have a single forward-pointing flagellum, which bears mastigonemes.
- the relative proportions of the chlorophylls and fucoxanthin produce a yellow-brown or greenish-brown colour in the plastids.
- most have a large central vacuole or pair of vacuoles.
- cells (especially during stationary-phase) often accumulate large quantities of lipids and fatty acids; polyphosphate bodies are also present and sometimes take the form of discrete spherical or complex ‘volutin’ granules, one per vacuole.
- secretion of extracellular polymeric material (usually polysaccharides) is common, as stalks, pads, capsules, tubes, chitin fibres, or trail material from locomotion.
- all cells (except the gametes and endosymbiotic diatoms) possess a bipartite cell wall comprising two overlapping halves.
- each half-wall itself consists of a large end-piece, the ‘valve’, and several or many narrow bands or segments, which together form the ‘girdle’.
- the cell wall is almost always heavily silicified.
- cell wall elements (valves, girdle bands, and auxospore scales and bands) are formed intracellularly, in special membrane-bound ‘silica deposition vesicles’ associated very closely with the cell membrane; they are not secreted from the cell until they are complete.
- new wall elements are always produced within the confines of an existing cell wall. As a result, average cell size usually decreases with successive mitotic divisions during the life cycle.
- size is restored via the formation and expansion of a special cell, the auxospore, which is usually a zygote. The basic shape of each diatom species is largely created during the expansion of the auxospore, but is often modified during subsequent mitotic cell divisions.
- during vegetative mitoses, the nucleus always lies to one side of the cell immediately beneath the girdle, at the edge of the hypotheca.
- mitosis is open, the nuclear envelope breaking down before metaphase; the spindle is a narrow cylinder, persistent at telophase, consisting of two interdigitating half-spindles, each associated with a polar plate.
- the chromosomes bunch closely around the cylindrical spindle at metaphase, becoming impossible to separate and count.
- cytokinesis occurs through cleavage.
- the life cycle is strictly diplontic: as far as is known, all vegetative cells of all species are diploid, and all mitoses take place in the diploid phase. However, haploids have occasionally been grown in culture in a few species.
- they occur just about everywhere in aquatic and damp terrestrial habitats, providing that photosynthesis is possible!
- they are amazingly diverse, with hundreds of genera and perhaps 200,000 species (Mann & Droop 1996), of which only a tenth have been described so far.
Relationships of Diatoms to Other Groups
Despite a number of studies to examine phylogeny, using one or several genes, the relationships of diatoms to other groups are still unclear and there is still a huge gap in our understanding of how and when diatoms acquired their unusual morphology and life-cycle characteristics. The diatoms have often been treated as a separate phylum, reflecting their unique features. Pascher (1914, 1921) suggested that the diatoms have features in common with the Chrysophyceae and Xanthophyceae and therefore placed these classes and the Bacillariophyceae in the phylum Chrysophyta. Ultrastructural and molecular sequence data have confirmed the general thrust of Pascher’s idea, placing the diatoms unambiguously among the heterokont protists (‘stramenopiles’) within the chromalveolates (Adl et al. 2005).
In the past, it was sometimes suggested that diatoms evolved well before their appearance in the fossil record and that the early phases in diatom evolution were lost long ago through diagenesis of diatomites to chert (e.g. Round 1981). This is made extremely unlikely by recent molecular phylogenies, which date the origin of diatoms towards the beginning of the Mesozoic Era. Furthermore, a close relationship to other silica scale or silica skeleton-producing algae and protists, such as the Chrysophyceae, is not evident in recent analyses. The closest known relatives of the diatoms are the bolidophytes (Bolidophyceae), which are a small group of marine autotrophic picoplankton with the same kind of plastids and flagellum structure as diatoms and some other autotrophic heterokonts (Guillou et al. 1999). However, bolidophyte cells are highly reduced and simplified and do not seem to produce any silica structures, although it is possible that silicifying life cycle stages have been missed.
Mann and Marchant (1989) suggested that another group, the Parmophyceae, may also be closely related to diatoms and thus may give hints as to how diatoms arose, because they produce silica scales that in some respects (radial pattern subtended by a central ring, space-filling development of pattern) resemble diatom valves and girdle bands. So far, no DNA sequences have been confirmed to be derived from Parmophyceae, but a clade of unknown heterokonts closely related to diatoms and bolidophytes has been detected by Lovejoy et al. (2006) and may represent the Parmophyceae; it is certainly important for understanding the evolution of both bolidophytes and diatoms that the organisms detected by Lovejoy et al. are fully characterized.
Round and Crawford (1981) and Mann and Marchant (1989) developed hypotheses about how the diatom frustule evolved, based on comparative morphology. Both suggested that diatoms probably arose from scaly celled ancestors. The scale-case was thought initially to have been homogeneous (all the scales were fairly alike in size, shape and structure). Then there was a stage in which the scales became differentiated into larger valve-like scales and narrower ones that resembled the segments found in the girdles of modern Rhizosolenia species (though this is not meant to imply that modern rhizosolenids are a basal offshoot), and a still later stage when the proto-girdle bands became even narrower, forming hoops around the cell.
According to this evolutionary progression, valves and girdle bands would have a common origin, which seems reasonable because their structure is often similar and they are formed in similar ways. Furthermore, cells covered evenly with scales are known in diatoms, in the auxospores of some centric diatoms, e.g. Melosira orEllerbeckia (Crawford 1974, Schmid & Crawford 2001).
The main differences between the Round–Crawford and Mann–Marchant hypotheses are in the assumptions made about the nature of the scales and scaly cell in the early (‘Ur’) diatoms and the nature of the scaly cells themselves. In the Mann–Marchant scheme, the scales of the pre-diatom were space-filling structures, which abutted to form the complete, functional cell wall of a temporarily dormant cyst, whereas Round and Crawford envisaged the scales as separate elements that did not abut but were imbricate, covering growing vegetative cells as in modern synurophytes.
No precursors of diatoms have been identified from the fossil record.
Discussion of Phylogenetic Relationships
Just as it is something of a mystery at present as to how and why the diatoms arose from among the other heterokont algae, so also we have little idea about relationships among the major lineages within the diatoms. At the generic level and, to a lesser extent, within families of diatoms, considerable progress has been made during the last 40 years, as a result of huge injections of new information and analysis, first from electron microscopy (particularly scanning electron microscopy), then from examination of cell structure and sexual reproduction – which are characteristics previously ignored by most diatomists – and most recently from molecular phylogenetics. However, these data have not yet provided a clear idea of higher-level relationships in diatoms, among families, orders and classes. Round et al. (1990) described many new genera and resurrected others from obscurity, on the basis of morphological and cytological surveys; these have on the whole been supported by subsequent investigations, including studies based on molecular data. Round et al. also provided a new framework of classes, orders and families to ‘hold’ the revised genera. These have not been so successful. Gene sequence data have shown over and over again that informal analysis of relationships, based on morphology, often fails to reveal the true pattern of evolution. The problem seems to be that parallel or convergent evolution of shape and wall structure has been rampant within the diatoms. But in many cases, molecular analyses have also failed us thus far, partly because of convergent evolution and partly because of analytical difficulties, such as establishing homology in rDNA sequences and hence developing a correct alignment matrix.
Round et al. divided the diatoms into three classes: Coscinodiscophyceae, Fragilariophyceae and Bacillariophyceae, which correspond to three of the main types of valve organization. The Coscinodiscophyceae were to be recognized by having valves in which the pattern of ribs and striae (lines of pores) radiates out from a ring (the annulus). In the Fragilariophyceae, the pattern was feather-like, with the ribs and striae being arranged either side of one or two longitudinal ribs or strips (sterna). And in the Bacillariophyceae, the pattern was similar to that in in the Fragilariophyceae, except that the central strip contained a raphe system. Informally, these three structural variants can be referred to as ‘centrics’ (Coscinodiscophyceae), ‘araphid pennates’ (Fragilariophyceae) and ‘raphid pennates’ (Bacillariophyceae).
Although analyses of molecular sequence data have not yet provided us with a clear picture of the early evolution of the diatoms, one thing has become obvious: the Round et al. three-class system is wrong, if the aim is to reflect phylogeny. The phylogenetic trees that have been published during the last 15 years disagree in many respects, but all show the primary radiation to have occurred among diatoms with a centric valve structure, the pennates having evolved later, from ancestors with centric structure. Furthermore, the Fragilariophyceae are not monophyletic, being paraphyletic with respect to the Bacillariophyceae. So, of the three Round et al. classes, only one – the Bacillariophyceae – is satisfactory.
The main features that appear in several phylogenetic trees (once the topologies of the trees have been simplified to include only those relationships that have good statistical support) are:
- a basal polytomy of clades, all but one of which have circular valves (very rare exceptions) with a centric valve pattern and monopolar or radial symmetry; the clades with circular valves and centric organization are often referred to as the ‘radial centrics’. The ‘radial centrics’ may be a monophyletic group and appear so in some published trees; on the whole, however, it appears that they are not.
- a further clade in the basal polytomy that comprises the remainder of the centric diatoms and all of the pennate diatoms. The centric diatoms in this clade usually have a polar organization. The pattern still radiates from an annulus, but the valves are usually elliptical or elongate, triangular or triradiate, etc, and the structure of the valve shows bi- to multipolar symmetry; circular valves are uncommon and possible secondarily derived. Centric diatoms of this kind are often referred to as ‘polar centrics’.
- the polar centrics rarely appear in molecular phylogenies as a monophyletic group; instead, they are usually paraphyletic with respect to the pennate diatoms.
- the pennate diatoms are monophyletic.
Medlin & Kaczmarska (2004) proposed a replacement for the Round et al. scheme, based on interpretations of molecular and some nonmolecular data, in which the diatoms were divided into two subphyla, Coscinodiscophytina (= ‘radial centrics’) and Bacillariophytina (‘polar centrics’ + pennates), and the Bacillariophytina in turn into two classes, the Mediophyceae (‘polar centrics’) and Bacillariophyceae (pennates). Note that Medlin & Kaczmarska’s use of ‘Bacillariophyceae’ (all pennate diatoms) differs from that of Round et al (1990) (only raphid pennate diatoms). It is very likely that the Mediophyceae are paraphyletic and quite likely that the Coscinodiscophytina are also paraphyletic. Because of this, and because some published molecular analyses are said not to be repeatable, the Medlin–Kaczmarska scheme has been heavily criticized (e.g. Williams & Kociolek 2007). However, the new classification does have the virtue, relative to the Round et al. (1990) classification, that it reflects better the finding, now generally agreed and consistent with the fossil record, that diversification occurred first among diatoms with a centric valve structure, and that pennates evolved later from within one out of several or many centric clades. Although this is not a new idea (e.g. Simonsen 1979), it was only one of many possibilities aired before the advent of molecular systematics (see Mann & Evans 2007).
Adl et al. (2005) adopted Medlin & Kaczmarska’s names but noted that the Coscinodiscophytina and Mediophyceae might be paraphyletic. Here, Medlin & Kaczmarska’s formal taxa are used only where there seems to be good support for monophyly (i.e. the Bacillariophytina and Bacillariophyceae). Nevertheless, it is often useful to distinguish Medlin & Kaczmarska’s Coscinodiscophytina and Mediophyceae informally, as ‘radial centric diatoms’ and ‘polar centric diatoms’, to highlight what seems to be a well-established feature of diatom evolution, that complex shapes and bi- or multipolar structure developed in one clade of centric diatoms (within which the pennates evolved later), but not in several others.
Global Significance
It has been known for a long time that diatoms are abundant in aquatic habitats, forming an essential part of many food chains. However, it was not until the 1990s that their huge contribution to the global carbon economy began to be fully appreciated. A back-of-the-envelope calculation (Mann 1999) goes like this:
- total net primary production for the globe is ~ 105 Pg carbon per year (Field et al. 1998)
- of this, about 46% occurs in the oceans and 54% on land (Field et al. 1998)
- of the oceanic component, about one-quarter (11 Pg) takes place in oligotrophic (nutrient-poor) regions, one-quarter (9.1 Pg) in eutrophic (nutrient-rich) regions, and half (27.4 Pg) in the remaining mesotrophic regions (Field et al. 1998)
- diatoms account for no more than 25-30% of primary production in nutrient-poor waters, but perhaps 75% in nutrient-rich regions (Nelson et al. 1995); so, assume an intermediate value of 50% for mesotrophic waters
- the total contribution made by diatoms is then {(11 × 0.25) + (27.4 × 0.5) + (9.1 × 0.75)} = 23.275 Pg carbon per year, which is ~ 23.5% of the global total
It’s probably an overestimate, but the importance of diatoms is evident nonetheless. For comparison, all the world’s tropical rainforests fix 17.8 Pg, all the savannas 16.8 Pg, and all the world’s cultivated area another 8 Pg. The fate of the carbon that diatoms fix is now a crucial issue in climate-change research.
Another way to appreciate diatoms is to realize that they give us every fifth breath, by the oxygen they liberate during photosynthesis.
General Texts
Round, F.E., Crawford, R.M. & Mann, D.G. (1990). The diatoms. Biology and morphology of the genera. Cambridge University Press, Cambridge. 747 pp.
Stoermer, E.F. & Smol, J.P. (1999). The diatoms. Applications for the environmental and earth sciences. Cambridge University Press, Cambridge. 488 pp.
van den Hoek, C., Mann, D.G., Jahns, H.M. (1995). Algae. An introduction to phycology. Cambridge University Press, Cambridge.
References
Adl, S.M., Simpson, A.G.B., Farmer, M.A., Andersen, R.A., Anderson, R.A., Barta, J., Bowser, S., Brugerolle, G., Fensome, R., Fredericq, S., James, T.Y., Karpov, S., Kugrens, P., Krug, J., Lane, C., Lewis, L.A., Lodge, J., Lynn, D.H., Mann, D.G., McCourt, R.M., Mendoza, L., Moestrup, Ø., Mozeley-Standridge, S.E., Nerad, T.A., Sheraer, C., Spiegel, F. & Taylor, F.J.R. (Max) (2005). The new higher level classification of eukaryotes and taxonomy of protists. Journal of Eukaryotic Microbiology 52: 399-451.
Field, C.B., Behrenfeld, M.J., Randerson, J.T. & Falkowski, P. (1998). Primary production of the biosphere: integrating terrestrial and oceanic components. Science 281: 237-240.
Crawford, R.M. (1974). The auxospore wall of the marine diatom Melosira nummuloides (Dillw.) C. Ag. and related species. British Phycological Journal 9: 9–20.
Guillou, L., Chrétiennot-Dinet, M.-J., Medlin, L. K., Claustre, H., Loiseaux-de Goër, S., Vaulot, D.: Bolidomonas: a new genus with two species belonging to a new algal class, the Bolidophyceae (Heterokonta). Journal of Phycology 35, 368–381 (1999).
Lovejoy, C., Massana, R. & Pedrós-Alió, C. (2006). Diversity and distribution of marine microbial eukaryotes in the Arctic Ocean and adjacent seas. Applied and Environmental Microbiology 72: 3085–3095.
Mann, D.G. (1999). The species concept in diatoms. Phycologia 38: 437-495.
Mann, D.G. & Droop, S.J.M. (1996). Biodiversity, biogeography and conservation of diatoms. Hydrobiologia 336: 19–32.
Mann, D.G. & Evans, K.M. (2007). Molecular genetics and the neglected art of diatomics. In: Unravelling the algae – the past, present and future of algal systematics (Ed. by J. Brodie & J. Lewis), pp. 231-265. CRC Press, Boca Raton, Florida.
Mann, D.G. & Marchant, H. (1989). The origins of the diatom and its life cycle. In J. C. Green, B. S. C. Leadbeater & W. L. Diver (eds.) The chromophyte algae: problems and perspectives (Systematics Association Special Volume 38), pp. 305–321. Clarendon Press, Oxford.
Medlin, L.K. & Kaczmarska, I. (2004). Evolution of the diatoms: V. Morphological and cytological support for the major clades and a taxonomic revision. Phycologia 43: 245–270.
Nelson, D.M., Tréguer, P., Brzezinski, M.A., Leynaert, A. & Quéguiner, B. (1995). Production and dissolution of biogenic silica in the ocean: revised global estimates, comparison with regional data and relationship to biogenic sedimentation. Global Biochemical Cycles 9: 359-372.
Pascher, A. (1914). Über Flagellaten und Algen. Berichte der Deutschen Botanischen Gesellschaft 32: 136–160.
Pascher, A. (1921). Über die Übereinstimmung zwischen den Diatomeen Heterokonten und Chrysomonaden. Berichte der Deutschen Botanischen Gesellschaft 39: 236–248.
Round, F.E. & Crawford, R.M. (1981). The lines of evolution of the Bacillariophyta. I. Origin. Proceedings of the Royal Society of London, B 211: 237–260.
Schmid, A.-M.M. & Crawford, R.M. (2001). Ellerbeckia arenaria (Bacillariophyceae): formation of auxospores and initial cells. European Journal of Phycology 36: 307–320.
Simonsen, R. (1979). The diatom system: ideas on phylogeny. Bacillaria 2: 9–71.
Williams, D.M. & Kociolek, J.P. (2007). Pursuit of a natural classification of diatoms: history, monophyly and the rejection of paraphyletic taxa. European Journal of Phycology 42: 313-319.
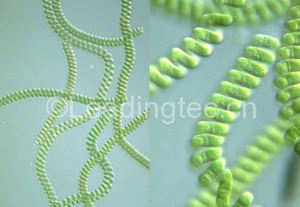
如何判斷中肋骨條藻的狀态
由于中肋骨條藻的實驗室培養比較困難,1.5年左右就會衰退,需要重新在海域采集,因此很多客戶在實驗室判斷中肋骨條藻的狀态就遇到困惑。
中肋骨條藻狀态好的話,細胞一個一個的很飽滿,連成10~30個每條鏈,由于沒有鞭毛,它不會動的。
什麽藻可以超低溫保存
超低溫保存隻适合于部分矽藻和藍藻,并不是所有藻都合适,有鞭毛的藻也不能進行超低溫保種,即使保種成功了,成活和複壯率很低的,隻有不到10%左右。成活的從低溫取出到完全複壯也要3個月時間。
請問東海原甲藻是無色的嗎?密度大的時候會産生顔色嗎?
有顔色 密度低時沒有 高時是棕黃色 密度最好可以到10 的6次每毫升。
培養夜光藻的方法
培養夜光藻的關鍵并不是培養基的配方而是在于混養,夜光藻需要吃藻才能生長良好,一般可以考慮混養扁藻
藻類如何破壁
藻類細胞破壁技術作爲一種高科技手段,其應用十分廣泛。除病毒外,一切生物均由細胞構成,根據細胞内核結構分化程度的不同,細胞可以分爲原核細胞和真核細胞兩大類型。細胞壁(cellwall)是細胞的外層,在細胞膜的外面,細胞壁之厚薄常因組織、功能不同而異。植物、真菌、藻類和原核生物都具有細胞壁,而動物細胞不具有細胞壁。細胞壁本身結構疏松,外界可通過細胞壁進入細胞中。
藻類的細胞破壁最有效的方法就是采用液氮研磨
液氮研磨在分子生物學實驗中應用廣泛,特别是有關核糖核酸(RNA)、脫氧核糖核酸(DNA)的分離。液氮的溫度爲一196℃,它既能使各種組織成分不易被破壞或降解,又能使組織變硬,脆性增加易于磨碎。正是由于液氮的溫度極低,操作時要特别小心。液氮研磨,一是爲了終止細胞内外一切生物反應,比如提取RNA時,防止RNA酶的降解反應等;還有一個原因,就是在液氮中的細胞完全凍硬了,研磨可以達到很好的破胞效果,将細胞磨成粉,使裏邊的物質釋放出來。
當前小球藻成品市場的相關價格及使用方法?
2012年年底開始,小球藻成品開始在市場上銷售。5kg罐裝的銷售價格可咨詢當地經銷商,适用于5~8畝。
首先,因爲小球藻是一個活體的藻種,生産出來之後必須在0℃~4℃低溫保存,但也不能結冰,因爲結冰後小球藻細胞壁會破壁,膨脹後就會壞死,0℃~4℃度範圍内可以确保小球藻的種質完好。由于是高濃縮的藻種,小球藻的保質期不長,在低溫狀态下能保存3個月左右。
所以,小球藻的使用方法是先從冰箱裏取出來,放入大桶,不需要加水,讓其自然升溫。等小球藻的濃縮液和周圍氣溫差不多的時候,在放入桶内,倒入小球藻加水加培養基後讓其曝氣活化,24h左右後下塘再使用,效果非常理想。
海水種小球藻保存的适宜溫度是多少?
海水小球藻的适宜生長溫度其實和淡水藻種差不多,在南方适應性可能會更好一點,尤其是湛江、海南等接近熱帶地區的省份,常年的溫度都在25℃~35℃,非常适合小球藻的生長,20℃以下低溫的生長條件就不太理想。
異養發酵小球藻濃縮液有幾種類型
根據用途不同,我們公司的異養發酵小球藻濃縮液可以分爲肥水和投喂兩種用途,肥水的小球藻濃縮液濃度是每升幹物質在60-70g,投喂的小球藻濃縮液濃度是每升幹物質90-100g。
投喂的小球藻濃縮液可以根據投喂對象的不同配比營養物組成,控制蛋白質,脂肪的比例。
肥水小球藻濃縮液适用于全國大部分地區的水質,但是建議客戶在大批量購買前,先購買少量試驗一下。
如需使用小球藻幹粉請不要選擇購買濃縮液然後幹燥的方式,直接購買我們的小球藻粉性價比更高。
怎樣鑒别小球藻真假?從産品包裝外型上能否區别真假藻種?
小球藻首先要生存在水體中,鑒别小球藻的真假主要是看它的儲存方式。如果有宣傳說小球藻方便簡單易用,而且不需要低溫保存來抑制小球藻的活性,那麽這種小球藻産品十有八九是假貨。同時不能是幹燥的,必須是液體保存。而且我們的小球藻濃縮液是通過專利技術高密度保存,即使是低溫保存,保質期也不超過3個月。所以,市面上宣傳常溫條件下能保存1年并且能随時使用的小球藻産品也是假冒的。
從産品包裝外型上區分不了藻種真假。滿足低溫保存條件,就說明該藻種50%是真的。剩下一半的真假性就需要把藻種放到顯微鏡下檢測來确定。
清除藻類培養瓶上白色物質
有誰知道藻類培養過後,培養瓶上留下來的一層白色物質是什麽?有什麽辦法在洗瓶子的時候把它清理幹淨?我看那個放培養液的瓶子裏也會殘留一點,但是沒有培養藻液瓶子裏的留得多
答:這些白色物質一般是鹽沉澱,用稀鹽酸或者高錳酸鉀泡
螺旋藻有哪些真實準确的作用
市面上常見的螺旋藻突出它的保健效果,我們沒有此領域的補充,主要是從螺旋藻營養組成角度分析螺旋藻的作用。
WHO于2008年公布的《6個月到5歲中度營養不良兒童的食物與營養成分選擇》對于螺旋藻的推薦意見:“有些研究顯示螺旋藻對于改善兒童中度營養不良可能有一定幫助。”因此聯合國有個計劃就是在非洲糧食短缺地區推廣螺旋藻以解決糧食危機IIMSAM Sustainable Spirulina Outreach Program .:. Sustainable Development Knowledge Platform
根據對螺旋藻的成分分析,螺旋藻蛋白質含量的确很高,但僅限于和一般蔬菜相比。牛奶雞蛋的蛋白質含量不但更高,還更優質.某些地方有螺旋藻鍋底的火鍋,據說味道不錯。
FAO在1974年說過螺旋藻是“未來最佳食品”,可FAO這個定義也明确指出:隻有在特定情況下,即糧食極度缺乏,資源匮乏,螺旋藻才可以作爲一種投入産出比較高的作物暫時替代常規食品。這一點在2008年FAO發布一份報告也有體現。
這份報告推薦的螺旋藻開發方向是:解決貧困地區的營養問題;廢水處理;代替部分家禽、牲畜以及漁業養殖的飼料以降低生産成本;在緊急狀況下暫時解決糧食問題。
“暫時解決糧食問題”完全是一種應急措施,隻有在遭受地震、洪水或者其他自然災害之後,常規糧食難以生産行的情況下,才可以生産螺旋藻來充饑。
NASA和歐航局在上世紀80年代将螺旋藻作爲宇航員長期太空生存的推薦食物的原因,也是源自空間站的空間限制。因此在特殊年代和背景下,FAO以及IIMSAM等國際組織對于螺旋藻的積極态度,也都隻是着眼于它有助于解決糧食短缺問題而已。
螺旋藻主要的營養成分是藻藍蛋白,其他的都次要,國内有實驗室以前做過将藻藍蛋白與癌細胞融合,結果使得癌細胞弱化了不少,當然這個可能不能直接證明抗癌作用。
在韓國78名60歲以上老年人中進行的:連續16周、每天服用8克的螺旋藻補充劑的受試者比服用安慰劑者,其膽固醇水平降低,一些免疫系統功能指标亦有提升。螺旋藻就是蛋白質含量高(高于60%)而已,最大的功效就是可以作爲日常攝入營養替代品。
小球藻需要在0℃~4℃保存,夏天可以放在溫度比較低的土窯或者深井保存嗎?
如果北方土窖的溫度高于4℃,保存時間會非常短。因爲高于4℃,小球藻很活躍,2~3d就會發黑發臭然後死亡。如果高于4℃,最好是在1~2d之内全部使用。
小球藻有什麽優勢和劣勢?
暫時來說,因爲許多的藻類都會倒藻,倒藻就會産生毒素,而小球藻作爲一個小型綠藻,基本不會産生毒素。作爲一種優勢藻種,它具有幾大優點:首先,溶氧充足;其次,亞硝酸鹽,氨氮的指标很低;第三、pH值非常穩定;第四,生長穩定,存活周期長。目前來說,小球藻唯一的美中不足就是pH值在培育前幾天會出現0.1~0.2的波動,而且要天氣晴朗時使用最好。
帶鞭毛藻的大規模培養如何選擇泵
在我們大規模培養藻的時候一般的管道泵是可以勝任循環工作的。可是在培養帶鞭毛的紅球藻和衣藻等帶鞭毛的藻的時候,告訴旋轉的葉輪對于這些藻來說是相當有殺傷力的。
因此在大規模培養帶鞭毛藻類的時候我們一般建議客戶在以下幾種泵根據具體情況選擇:
正弦泵、蠕動泵、隔膜泵、平葉泵
如果藻類過濾在濾膜上,保存在液氮裏,它還活着嗎?可不可以拿出來培養一下呢
一般保存到液氮要用dmso(二甲基亞砜)或或者甘油作爲保護劑,如果沒有加保護劑可以碰碰運氣用水浴迅速解凍,有可能有極少的活細胞 。
怎麽培養雨生紅球藻
雨生紅球藻的培養溫度要設在23±1度,營養細胞培養階段的光強設爲1300-1600lx,促進蝦青素積累的脅迫階段光強10000-12000lx,靜止培養的話每天手搖3-4次,防止粘壁。管道培養需設計相應結構。
EDTA緩沖液的配備技巧
EDTA的溶解度小,用純水加熱溶解也不是很多,一般都配成鈉鹽的溶解液,按照分子量配比。
或者配備EDTA溶解液的時候用NaOH助溶,加一點然後讓它溶一會兒,不行繼續。最終在培養液裏面EDTA的用量很少,不會影響整體的pH值
怎麽過濾死藻
螺旋藻隻能用撈金魚的400目的網,撈上層的活藻,其他的個體小的藻還是用濾紙過濾吧
至于其他藻類很難區分死藻活藻了,不過一般手動搖過之後一段時間内活藻是懸浮于液體中的,死藻則沉降,可以将懸浮液轉到幹淨的瓶子中離心收獲活藻
爲什麽你們的小球藻濃度沒有别人的高,價格卻比别人的貴
爲什麽其他每毫升200-300億的小球藻濃縮液才十幾塊到二十幾塊一公斤,而你們的才100億賣得還比他們貴呢?
市面上的小球藻濃縮液分爲自養和異養稀釋2種。
一般産品的小球藻濃度每毫升200-300億是包括細菌的數量,自養小球藻純度做到5億已經是極限了,而且保存時間很短。
我們的小球藻是發酵異養,高純度,沒有任何雜質,我們的每毫升100億是實打實的小球藻細胞。營養配比可以根據需要改變。高濃度情況下可以長時間保存。
異養稀釋的小球藻濃縮液基本上以我們公司的小球藻濃縮液原液爲基礎進行稀釋10倍投放市場,所以價格是我們公司價格的1/10才是正常的。
三角褐指藻三角長不出來退化處理
很多三角褐指藻實驗室培養到後來就退化了,三角長不出來了,在這種情況因環境而發生的,一般建議客戶增加營養鹽濃度 增加光照會慢慢好起來
什麽是小球藻濃縮液
小球藻是一種圓形的大小2-10微米的單細胞綠藻類,含有優質蛋白質60%以上,碳水化合物20%,葉綠素5%,大量的礦物質,維生素和生物活性物質。濃縮小球藻培是浮遊動物和初期魚苗的最佳餌料。
濃縮活體小球藻,是采用無菌發酵的方式生産,可以放心使用。常年穩定供應,運送迅速。完全解除了水産養殖育苗生産中餌料生物供應的後顧之憂。
本産品純小球藻,是針對貝類養殖、魚蝦育苗、輪蟲培養等水生動物營養均衡的需要而設置的定向培養。
産品成分: 小球藻濃縮液每毫升将近200億個細胞。
産品特點:
·使用方便,随泡随用,一年四季使用不受氣候影響。
·新鮮活力,營養均衡。
·成本低廉,本産品每升可培養3—5億輪蟲,相當于養殖戶培養10噸藻水。
·節省開支,降低風險,避免養殖戶因受氣候或其它因素影響,藻水密度稀或培養失敗而造成的一切費用和時間的浪費。
用法用量: 根據培養密度随機增減投喂量
儲藏方法: 放置在陰涼幹燥處,避免陽光直射
保質期限: 冷藏3個月
哪個牌子小球藻好
不管哪個品牌的小球藻片,小球藻粉,小球藻飲料制品,小球藻添加劑,上海光語生物科技有限公司的工程師都建議采用純發酵 的小球藻原粉作爲原料,才是最好最可靠的小球藻産品。
小球藻粉的發酵工藝和濃縮小球藻液的工藝完全不同,并非簡單使用濃縮小球藻幹燥獲得,兩者采用的是完全不同的國際頂尖工藝,避免了傳統的光養開放式培養過程中小球藻吸收了環境中的重金屬以及其他有害物質,是最優質的小球藻保健藥品、食品、飲料的原材料。
小球藻由于具有純天然、非提純、均衡含有人體所需的全面營養素和獨特的綠藻生長因子(CGF)、最高的葉綠素含量和堿性生成量,以及獨有的排毒功能等顯著品質,而成爲最科學、最合理、最可靠和最有效的純植物健康補助食品。
上海光語生物科技有限公司小球藻粉所采用的生産工藝經過多年的技術沉澱,伴随着現代生物科技的發展更成就了其産品的至臻至純。産品因行銷日本,歐美等世界各地而著名并備受用戶信賴。
上海光語生物科技有限公司小球藻粉發酵工藝選擇優質純種的蛋白核小球藻,在經過潔淨化處理的淡水及充足陽光的照射和清新空氣的天然環境中,用先進的質量控制及養殖技術進行培育,再經過純化發酵工藝和獨有的破壁技術處理,以領先的生物加工工藝和嚴格的品質檢驗精制成高純度,高吸收率,高活性,富含人體所需均衡營養素的高品質小球藻粉。
100%小球藻,不添加任何添加劑,并非一般産品可做得到。
世界技術最先進的小球藻發酵異養工藝,專業的生産廠商,營養按需定制
最高的C.G.F.(小球藻生長因子)含量!
味道是濃純正的水藻香味,但不腥臭
顔色濃綠色,表面均勻,沒有雜質(斑點)感,表面柔潤
濃縮小球藻液如何肥水
每年開春在投喂魚苗蝦苗蟹苗之前基本都要進行肥水,讓水裏有更多的浮遊動物,我們一般建議客戶使用藻類濃縮液進行肥水,傳統的自養藻基本隻能保存5-7天。肥水用的濃縮藻液甚至一個活藻都沒有,而僅僅是一些藻類培養基。
上海光語生物科技有限公司推出的小球藻水質改良劑,富含活體異養小球藻,常溫保存在10-13天左右,而且活性極高。我們的小球藻液有效活性物濃度是60-70g/L,相當于純小球藻細胞60-70億/ml。客戶使用一般的潑灑密度在按照10-50萬活體細胞/ml,請按照水體營養情況以及水體容積換算。自然水體小球藻的生存極限密度是500-1000萬細胞/ml(換算成幹物質0.05-0.1g/L)。
投喂濃度過高會導緻水體營養物無法滿足藻類生長需要造成活藻缺少營養發黃死亡。
注意,我們的小球藻細胞濃度指的是純小球藻活性物,不包含細菌數量。市面上的很多産品的細胞密度是包括細菌數量的,因此我們公司一般以藻液有效活性物濃度爲标準即每升多少克幹物質。
藻種低溫保存
在春節長假期間,很多單位實驗室放假,藻種的保存首選就是超低溫保存。
本方法适合于中、長期藻種保藏,保藏時間一般爲2-4年左右。
(1)用火焰滅菌的接種環取斜面藻種在平皿上劃線分離單藻菌落。
(2)平皿倒置于30℃或37℃恒溫培養箱,培養24-48小時,至單藻菌落的大小爲3mm左右。
(3)挑取一個單藻菌落,接種于一個裝50mL的300mL三角瓶中30℃或37℃振蕩培養10-15小時,至藻密度OD600爲1.0-1.5。
(4)用火焰滅菌的接種環取少量種子液,塗片後,作革蘭氏染色,在顯微鏡下觀察藻體的形态,及是否有雜藻。
(5)按30%甘油:種子液爲1:1(V/V)的量加入無菌甘油, 混合後分裝至事先滅菌的藻種保存管(1-2mL/管),-70℃或液氮保存。
用該法保藏過的藻種,如何活化?
保種的藻先接種在培養液裏活化好;配置50%的甘油溶液,滅菌;1:1加入,直接放入-80度;複蘇的時候,冰上融化,直接接入培養液中。
藻種管由傳統的玻璃藻種管改爲0.5ml帶蓋塑料離心管。
該改良法優點有:
⑴操作過程大大簡化,藻種管口不需溶封,不抽真空。
⑵藻種管抗破損性極佳;
⑶藻種管體積超小。
⑷成本低廉,易于商品化生産、推廣。
實驗室藻類培養避免污染注意事項
來自網友穎子:
如果大家是做開放式反應器培養的,污染會有,這也是它相對于密閉式培養的一個弊端,也會受季節影響。不過,如果是2L(甚至更大一些體積),我的理解還是屬于實驗室培養的,這樣避免污染相對簡單:傳代時培養基應該是除菌的,通氣時氣體應該在氣路上添加濾膜過濾一下,以保證氣體的除菌。這樣的培養我其實也發現過藻生長狀态有時也會和季節相關,雖然在培養箱中理論上不應該影響。不過,這個影響應該不是太明顯。
另外,這種搖瓶培養也會因爲操作不嚴格,尤其是一次管理多種藻,傳代同時進行等等時發生雜藻的污染,這就得從操作上更嚴格的克服,比如如果能用大容量移液器添加新鮮培養液,就盡量避免直接的傾倒,否則藻濺起來的飛沫很容易無意中進入培養基中,這樣你再傳代另一種藻就很容易污染.覺得移液器效率差,要不就專瓶專用吧,總之,得格外小心。
藻種生長退化的處理
網友穎子:關于藻種生長退化的問題我們培養過程中我們遇到過,有時是未及時傳代,污染甚至是莫名的原因都有可能。我的建議是如果能得到有其他保留的種,最好借一些重新再養,因爲以往經驗雖然在提供好的最優化條件繼續養有恢複的可能,但真的基本上狀态都很難再恢複,不如放棄重新去一些再養。尤其是有污染的藻種,更加麻煩。如果很精貴,無法再取得,那你就先再養養試試,不一定頻繁傳代就好。靜養先看看。有污染的話,不行固體培養篩一下,就是比較費時。
藻類生長使pH升高的原因
培養基制備基本方法
制備基本方法
培養基配方的選定
.培養基的制備記錄
培養基成分的稱取
培養基各成份的混合和溶化
培養pH 的初步調整
使用操作問題
污水處理采用菌藻共生的方案選擇細菌有什麽原則?
要根據使用環境來判斷,如果是沼液自身産生的都是厭氧菌,對于微藻耗氧環境就不能協同發揮作用,可以考慮在曝氣池中的活性污泥耗氧菌來協同生長。同理推斷其他的環境和針對藻細胞的特點來選擇高活性的菌種來發揮生物多樣性的功效。
如何減少培藻過程纖毛蟲污染
培藻過程出現的纖毛蟲污染,新大澤肖博士建議,避光靜置8小時,噴霧器在表面噴灑醋酸就死了.
培藻車間的防污染配置
微藻培養的車間需要設置一定的防污染淨化裝置來控制空氣和水中的競争微生物,減少有害細菌進入培藻水體的幾率。
培藻用水要過濾滅菌,采用強氧化劑(次氯酸、鹽酸、臭氧、紫外),在使用前用還原劑(大蘇打)去除強氧化劑的殘留。
培藻的培養基要徹底的滅菌殺毒,可以采用臭氧或者紫外或者煮開。
培藻的車間需要穿雨鞋,進車間前門口配置5000-10000ppm的碘液來浸泡雨鞋,手上要用酒精或者臭氧噴灑。車間按照合适的位置要配置紫外燈殺滅環境中的微生物(同時避免對藻的傷害),對于氣源要過濾并且在氣泵房設置紫外燈保證細菌不要進入曝氣管路。
如何避免大規模藻類生産中一些不利情況
網友回複:藻類培養中及時傳代複壯有助于将藻細胞變形及基質濃縮,增生,胞質色素沉着,細胞數量減少,網狀空泡(水泡),聚縮藻團等不良現象減少,提高培藻效果
藻類生産過程中造成藻類狀态不好的因素有哪些
1、攪拌或通氣等過猛,藻細胞破裂,蛋白溶出;
2、光強度太小或太大,藻細胞自溶;
3、培養液鹽度(滲透壓)不合适,藻細胞破裂;
4、其有毒有害物包括試劑品質不合格。
僅供參考。
養蝦過程如何添加螺旋藻粉
螺旋藻要過100目篩揉洗于水中投喂。按照蝦苗數量分次投,大約是每立方米水體1克左右粉。要技術員觀察苗的食用效果。(注意殘餌量。從溞狀(1–6期),糠蝦期喂最佳。注意殘餌對水質的影響。
18s測序藻細胞需要多少
一般建議客戶取100微升,十幾個細胞就可以,多了幾百個會使得胞内菌對測序結果産生影響。
如何控制微藻培養過程中的蟲污染
1、添加400-800ppm的NH4HCO3;
2、添加CO2,控制pH在5.8-6.0;
3、添加5至10ppm的銅離子(Cu2+);
4、往水體加入20kHz的電磁波
如何制作矽藻膠
矽藻的樣品不能簡單使用甲醛或者其他試劑固定,時間久了色素退化或者矽質殼被化學分解掉,在做矽藻樣品固定封片的時候,最後關鍵一步是點一點矽藻膠(Naphrax)封片,這裏的矽藻膠如果直接購買100ml大概需要7-8千人民币。自己制作的話就是購買加拿大樹脂和二甲苯色譜純等體積混合浸泡直至溶解。(加拿大樹脂可以用Cargille公司制造的 Meltmount系列産品封固膠 Meltmount 1.680代替)
比較環保的殺菌殺藻産品有哪些?
研究了碘伏和異噻唑啉酮除藻劑對球形棕囊藻赤潮生物的滅殺和控制作用.結果表明,單獨使用時,碘伏的最低 有效濃度爲30mg*L-1,異噻唑啉酮最低有效濃度爲0.30mg*L-1.當兩者複配時有協同作用,可提高它們的殺藻能力.碘伏與異噻唑啉酮濃度比爲 1.0∶0.15時除藻效果最佳.
還有木醋液配合苦楝素、印楝素、苦棟素、苦豆堿、賴素、煙堿、蒼耳水殺藻效果也很好而且環保。
還有常見的辣椒素用量很少效果極佳。
藻藍蛋白和葉綠素的檢測方法是什麽?
一般藻粉裏面藻藍蛋白和葉綠素的檢測方法是采用SNT1113-2002《進出口螺旋藻中藻藍蛋白、葉綠素含量的測定方法》
如何進行微藻基因測序鑒定?
請問鑒定微藻是否可以通過18S測序鑒定,有無通用的引物?
微藻分子測序鑒定沒有公認的條形碼,一般常用的是18s,rbcL和ITS基因,分子鑒定前最好先用形态學大緻鑒定一下,确定目和科,能确定屬最好,然後去NCBI看看哪種分子标記數據多,然後選擇該标記,一般選兩種,例如常用的18S和rbcL,經營比對鑒定,但是18S和rbcL還是比較保守,隻能在種水平以上适合,如果種内不同株的鑒定比較困難,18s通用引物有的,查文獻可以,一般的藻類鑒定文獻都有詳細介紹方法。
如何保持藻類培養過程培養液pH的穩定
一般培養過程中藻類的生長會導緻pH升高,爲了長期培養我們需要在培養液配方裏面加入一些緩沖劑來保證pH的穩定。一般的培養基配方都是經過優化的,如果選擇包含tris成分的培養基,培養過程pH變化比一般不加tris的要穩定很多。比如TAP、ESM、K-medium等等。
注:tris=三羟甲基氨基甲烷
沒有高壓滅菌鍋,怎麽才能做到無菌消毒
可以購買現成的光語生物無菌培養基。你隻需要準備無菌培養容器,移液管,和其他和藻類培養直接接觸的物品。你也可以用微波消毒設備和配制好的培養基。微波殺菌方式可在網上查詢
在使用光語培養基之前要高溫高壓滅菌嗎
光語的培養基在出廠經過2次滅菌和濾膜過濾。如果您 收到貨後開啓過一次保存一段時間再使用,建議您需要再次高溫高壓滅菌或者濾膜過濾也可以。如果是高溫高壓滅菌,你會失去一個輕微的液體量,從而增加比例的成分比例。氨會蒸發從而降低氨濃度。維生素應冷藏,維生素如果高溫高壓會使得成分失效,建議用濾膜過濾
光語的海水如何過濾
我們有最先進的海水過濾系統, 從相鄰的海灣提取海水. 經過三層PP棉淨水過濾到一噸的桶裏面; 把海水運輸到實驗室. 然後通過一個三級濾芯超濾過濾系統,經過1微米的濾孔後使用。
海水藻的培養水體鹽度是多少
光語生物的藻種一般保種采用千分之30的鹽度的海水,也有部分低鹽度的會特别标注,默認都是千分之30.
養殖水體如何控制藍藻?
藍藻爆發對養殖水體的破壞是非常巨大,藍藻分泌的毒素會導緻全部養殖品種死亡,損失巨大,到了藍藻泛濫的後期再去用藥都是得不償失的,而且所謂的藥物治理藍藻成功都是概率性事件。
前期的控制尤爲重要,我們一般分析藍藻爆發是由于向水體投放了大量的飼料使得水體富營養化,同時高溫,這個時候所有的藻類包括餌料藻以及藍藻都迅速生長處于一個平衡狀态;
由于藻類進行光合作用迅速,使得水體中的含氧量升高,而二氧化碳含量降低,pH逐漸升高,而藍藻相對于餌料藻更适應高pH的水體環境,這個時候藍藻生長速度快于餌料藻;
餌料藻生長環境收到抑制,同時被浮遊動物和養殖品種作爲食物消化掉,而藍藻消化不掉,使得藍藻占比越來越高。
最終藍藻死亡分泌毒素造成嚴重的經濟損失。
前期的控制要按照如下步驟:
1、飼料投放嚴格按照少量多次的原則 ,避免水體富營養化。
2、在藻類旺盛生長的時候也要往水體爆氣,增加水體二氧化碳含量或者其他增加水體碳源的物質。
3、及時向水體補充餌料藻,例如小球藻等增加生物競争,使得藍藻無法成爲優勢種群。
4、檢測水體的pH變化及時采取措施
離心機可以控制細菌嗎?
微藻培養會遇到很多細菌,因爲細菌個體小,所以在12000rpm轉速的情況下,可以把微藻離心出來,而離心力對細菌不夠,細菌會随着清水流走,這種方法可以洗掉大部分的細菌。
微藻破壁技術有哪些
目前用到的破壁技術有高壓均質、超臨界水處理、脈沖電場等方法
藍藻中能夠提煉出殺滅藍藻的無公害藥物嗎?
藍藻裏估計不會,但是有金藻裏産藻類生長抑制化合物的報道
爲什麽培養初期不能給藻類提供24小時持續強光照
在藻類培養初期,一般要求客戶使用14:10或者12:12的光照周期,或者是20:4的光照周期而不提倡24小時的持續光照,這裏面的原因是什麽呢?
根據我們在剛接種的時候微藻濃度較低的情況下,強光照持續實驗的結果,光照頂多能增加微藻澱粉、多糖等物質的含量,如果你要想獲得活性物質的話,類似毒素、不飽和脂肪酸等反而會減小,而且藻種會退化,過早進入生長衰退期,稱爲光中毒現象。
如果在生物反應器裏面進行培養,後期藻液濃度高到一定程度的時候,我們還是建議客戶采用24小時持續光照的。
上海光語生物科技有限公司的60L光生物反應器,可以根據設定的光照亮度值,自動調節led的光強,led的光強會根據藻液變濃而變強!
光照強度lux與光量子強度μmol/m^2-s 一般換算關系
在生産科研過程中會遇到光強 單位和光量子強度單位的換算,這2種單位沒有嚴格的換算關系,是不同的計量方式。
由于光源不同,比例就會改變
主要還是跟光線的組成有關系,不同光源的組成波長會相差好大,光源的能量也會相差很大
1 μmol/m^2-s =55.6 lux ,
1 W/m^2 = 4.6 μmol/m^2-s
1 μmol/m^2-s =71.4 lux,
1 W/m^2 = 5.0 μmol/m^2-s
池塘藻類培養需要不斷追肥嗎?
在養殖過程中,養殖者忽視了藻類營養的來源,普遍認爲中後期投餌量和排洩物的增加,可爲藻類生長提供源源不斷的營養。其實不然,殘餌和排洩物中的營養成分大多要通過生物轉化才能被藻類吸收,且可供藻類吸收利用的部分相當有限。因此,中後期适時追肥培藻很有必要。
藻細胞如何破壁?
在提取藻細胞物質的實驗之前,不可獲取的需要進行藻細胞破壁處理!
比較好的破壁的方法包含液氮研磨、甲醇超聲攪拌提取-氯仿萃取、酸溶液凍融。
濃縮小球藻藻液如何使用
市面上很多濃縮小球藻藻液是通過離心的方法獲得的,離心對細胞結構會産生很大的破壞,所以顯微鏡下面看到的小球藻細胞是破碎的不完整的。自然培養的還帶有藍藻,細菌,水體病害病毒等,濃縮後這些緻病緻死因素濃度更高,極大威脅健康水體的養殖品種。
上海光語生物科技有限公司的濃縮小球藻藻液是通過異養獲得的不經過離心就能達到非常高的每毫升100億完整小球藻細胞個體,使用過程可以按照1:100稀釋,每1噸的藻水添加1公斤複合肥。曝氣培養,然後再投放到水體裏面。
我們保證不含有害病毒、細菌、藍藻等對養殖品種有威脅的微生物和抗生素産品,緻力于爲養殖戶建立無抗生素的養殖環境而努力。
大規模培藻用什麽光源?
培藻用的燈一般用金鹵燈, 400或者450w,照度有20000lux,一米距離處,這樣才最接近陽光,飛利浦的質量比較好!或者全光譜LED
如何判斷小球藻濃縮液的品質?
1、小球藻的培養水體不能含有病害,否則濃縮液導緻使用水體出現病害;
2、小球藻的培養水體不能含藍藻等雜藻細菌,這些藍藻帶到健康水體所帶來的水華會毒害養殖品種,降低水體的肥料抑制健康浮遊生物生長,水體生态惡化
3、計數方式要科學,小球藻自然水體培養最高濃度就是1000萬細胞每毫升,濃縮一下也就是最多10億細胞了,而号稱幾百億都是包含了細菌和病毒細胞的,這種高濃度濃縮液本身就是傳播病害和藍藻的。
4、顯微鏡鏡檢能看到完整的小球藻細胞,看不到小球藻細胞的那些都是營養液而已,活體小球藻細胞決定了種群優勢是否可以戰勝其他藍藻和病毒獲得水體的營養從而抑制其他有害藻類細菌生長!另外就是細胞要完整,如果看到破碎的細胞很多就是經過離心,這種小球藻效果上大打折扣的。
上海光語生物科技有限公司的小球藻濃縮液采用異養培養,3天發酵無菌純培養後濃度可以在每毫升20-100億,經過誘導後品質活性葉綠素含量極佳,是目前市面上最可靠的小球藻濃縮液産品,肥水投喂都将保證水體安全和養殖品種健康!
藻類水體和通氣量的關系
很多客戶問養了10L的藻,這個通氣量如何把握呢?一般來說, 雨生紅球藻,10L的溶液,進氣量是30L/h,密度在每毫升100萬細胞左右。
其他藻以此類推,密度高了,通氣量就多點,密度低了,通氣量就少點
分選藻的時候用什麽儀器設備
一般在藻類篩選的時候我們采用的膠頭滴管燒了拉細或者毛細管虹吸效應來提取單細胞藻類;也可以用10微升的移液槍長槍頭,取一個細胞換一個槍頭
充氣培養産生泡沫原因分析及解決辦法
泡沫是指不溶性氣體分散在液體或熔融固體中所形成的分散物系,它是許多聚在一起的小氣泡。
一般來講,大量穩定泡沫的形成常常是因爲液體中含有某種表面活性物質,比如大多數的洗衣粉、洗潔精,香皂等。表面活性劑的一端含有親水基團,另一端含有疏水基團。通氣時,液體中的表面活性劑在氣體的作用下每個分子的親水端背靠背排列,親水端指向一邊,憎水端指向另一端,從而形成一個相互相似相容引力的薄膜,即形成了泡沫。
養金魚的魚缸也會因爲氣泵産生泡沫,這是清水氣泡,不穩定,極易破碎,通常魚缸循環水有氣泡收集裝置,把氣泡打碎或者轉移。而藻類培養過程中産生的氣泡,通常會使培養液變渾濁,粘稠度增大,細胞内的營養物質充當了表面活性吸附劑的作用,形成了大量的氣泡,這些細胞往往會凋亡,繼而釋放難聞的惡氣味,培養液呈乳白色。可以說,泡沫是藻生長不良的表征,是細胞衰退走向死亡開始,應特别注意就是。
充氣培養過程中産生泡沫原因分析:
1.通氣時氣泡過大過密集。氣泵:選擇合适的小功率氣泵,連接氣閥,旋轉氣閥調節氣體進入強度。氣頭:選擇冒小氣泡的氣頭(bubble size< 2 mm),調節氣閥,使氣泡最好是一個接一個形成一小串,而不是劇烈通氣,氣泡造成培養基上部翻動。
2.細胞破碎:氣泡過大造成細胞破碎,形成帶有顔色的氣泡。我做甲藻細胞周期實驗,用150L大缸培養,氣泡過大,因爲甲藻細胞壁較脆弱而破碎,培養液乳白色,形成白色泡沫。
3.染菌:尤其是培養條件不是很好的地方嗎,可以在氣泵和氣頭之間可以串聯一個0.22微米的濾頭,對空氣進行過濾,減少細菌的注入。
4.藻類代謝物:我們在培養産油綠藻的時候發現,培養液面層會出現一層白色的膜,經檢驗不是菌膜,是油脂成分。
總之,充氣過程中出現泡沫,一定要注意。
A:藻體分離,離心或者篩絹過濾收集細胞,無菌海水淋洗去除泡沫
B:重新配制培養基
C:抗生素處理細胞
D:重新接種
關于海水高溫高壓滅菌後析晶問題
藻類培養過程中通常海水需要高壓滅菌,無論是人工海水還是自然海水,經0.45/0.22微米濾膜先後過濾之後進行滅菌。但冷卻時經常會遇到海水析晶現象:海水裏出海針狀結晶。有時候即使不打開滅菌鍋,一直等海水在滅菌腔自然冷卻,仍會出現析晶現象。
原因大概如下:
1.滅菌後體積減少,揮發太多導緻鹽分析出。
小體積(100毫升以下)可以用0.22微米濾膜過濾除菌。若必須高壓滅菌,通常先滅大瓶海水和小空瓶,然後分裝。
2.滅菌溫度過高,水分蒸發太多而析晶。
我們通常設置滅菌條件:110~115℃,20~30分鍾。多次驗證表明,不會出現析晶現象。
3.瓶子包紮太嚴實,内外氣壓失衡,海水大量噴出。
因此,瓶口勿包紮太緊,滅菌結束取出再擰緊即可。
4.滅菌之後海水最好是自然冷卻,水浴降溫海水易結晶。
通常是滅菌完成後溫度降到70度以下立即取出于室溫自然冷卻。忌設置保溫過夜。
5.營養鹽各組分互相反應形成螯合物。
因此,高濃度營養鹽母液(NaNO3,NaH2PO4,Vitamins,Trace Metal,EDTA,NH4HCl等等)需要分開配制和保存。滅菌前或接種前添加,添加時用0.22微米濾膜過濾。
此外,矽藻培養實驗需要添加矽酸鹽(Na2SiO3.9H2O),如果加到海水再滅菌會出現乳白色沉澱。一般也是接種前添加,可用0.22微米濾膜過濾。
小球藻在生産上如何使用能達到最好的效果?
小球藻水産養殖生産中不光是應用于水質處理方面,也是魚蝦蟹的最天然的開口餌料。在人工養殖之前或者自然水體環境中,小球藻是首選的開口餌料。所以,我們應該在苗期之前就把小球藻培育出來作開口餌料,然後再應用到調水環節。
小球藻如果用來調節水質,在以下幾種情況是最合适的,一是水清、水瘦、水渾濁無藻種;二是水體倒藻之後急需穩定水質環境和培育優良藻種。這時候水發黑發臭,放小球藻可以快速穩定水體環境和降低魚蝦蟹的應激,從而減少發病的機率。因爲小球藻放下去就能繁養,處理水裏面的有害物質。三是用來與有害藻類競争,保持優質藻種的主導地位。
用農家糞或者農家化肥可以滿足小球藻的生存繁殖嗎?具體怎麽操作?
我們的培養基其實也有化肥的成分,但如果是農家糞或者農家化肥必須經過發酵分解成爲小分子的有機肥之後才可以投入到水塘,否則在水體裏藻類與其它微生物利用不了,魚蝦蟹消化也吸收不了,就會沉到池底使得水發黑發臭,影響水質。所以最好是用小球藻專用培養基或者是水産專用的肥藻膏等産品。如果是矽藻水,比較不穩定。因爲矽藻死亡之後,矽藻不容易被細菌分解重新利用,矽藻肥起來的水色難以保證存活周期,但小球藻就不會存在這樣的問題。
小球藻生長周期有多長?在任何土質的塘都能生存繁殖嗎?
小球藻通過不斷吸收營養和光合作用,大概8~12h左右就可以生長繁殖一代,如果營養鹽、天氣條件、水體環節變化不大的話可以一直生存下去。隻要有适合小球藻生存的營養鹽、天氣以及水質環境,任何土質的塘都可以生長繁殖。如果水質變化不大,塘的肥料條件比較好的話,小球藻可以存活15~20d左右。
小球藻可以在幹粉裏面培育嗎?
我們的小球藻是培育在培養液裏面,而不是幹粉裏面。我們也有些小球藻産品是放在幹粉裏,但不是應用于水質調節,而是用于苗種天然、優質的開口餌料。所以,我們提供的是培養液保存的鮮活細胞。我們有技術保障小球藻的活性,不會脫水,能夠在低溫條件存活3~5個月。
使用幹粉的任何藻種,包括小球藻是不可能存活的。因爲細胞脫水也是會導緻死亡的。
小球藻适宜的生活環境以及需要的營養是什麽?在水體存活時間長了會不會自然死亡?小球藻濃縮液産品如何保存?
小球藻适宜在25℃~33℃的水體環境下生存,營養鹽充足的情況下,小球藻在池塘裏培育起來後能達到長期穩定的效果。小球藻對水質指标要求不是太高,特别喜歡氨氮和亞硝酸比較高的水體,需要的營養鹽的碳肥和氮肥爲主,所以隻要池塘滿足一定的碳、氮條件就可以保障生存。如果是水泥池,我們也有專門的小球藻培養基供應。
小球藻在自然水體環境裏存活時間比較長,因爲小球藻屬于植物,植物會産生種子,小球藻也一樣。理論條件下,隻要水體裏面營養鹽合适、水質及天氣條件不是太差的話,小球藻可以通過自身不斷的更新換代達到藻相的平衡而一直存活下去。
小球藻濃縮液的保存條件也是低溫0℃~4℃,有效期可以達到3~5個月。
市場上有小球藻藻源産品放置會不會分層?銷售的小球藻怎麽運輸?
因爲小球藻的保存條件比較苛刻,需要0℃~4℃低溫保存,所以藻類銷售不是很方便,但産品都是真的。産品放置後一般都會分層,小球藻會沉到底部,上層是抑制活性的培養液。
小球藻銷售需要在泡沫箱内放冰袋密封冷藏運輸,保證泡沫箱裏面的溫度是0℃~4℃,可以進行3~5d長途運輸。達到目的地之後第一時間放入冰箱繼續低溫保存,小球藻的品質就不會受到太大影響。
光反應器消毒所用次氯酸濃度
我們一般采用200ppm的次氯酸浸泡12-24小時
有沒有簡單方法脫出或者提取藻中蛋白質
Bead beating(蛋白反複珠磨法)提取藻中蛋白質效果直接,處理簡單
魯哥氏碘液加冰醋酸的目的是什麽?
魯哥氏碘液,也稱魯哥氏溶液,魯哥試劑,是碘和碘化鉀的水溶液,1829年法國醫生J.G..A.Lugol發明,并以其姓名命名,魯哥氏碘液過去經常被用作消毒劑和殺菌劑,用于飲用水的應急消毒,實驗室常規試驗和醫學檢測中檢測澱粉。
爲什麽水泥池養藻重金屬會超标
因爲在部分水泥的燒制生産過程中,除了将碳酸鈣通過高溫燒成氧化鈣之外,還加入了比例較高礦渣,礦渣包含大量重金屬,因此用水泥池養殖需要将水泥池與水體通過塑料薄膜隔離或者用合适的油漆或者防水膠來隔離水泥和水體。
泥鳅吃什麽
泥鳅被譽爲“水中人參”,其味道鮮美,肉質細嫩,營養豐富。 泥鳅養殖是高效設施漁業發展中湧現出的一項新興産業。由于具有極高的營養價值與藥用功效,泥鳅的市場需求穩健,銷售價格相對穩定,從而吸引了不少民間資本投資泥鳅養殖。
在泥鳅育苗階段需要大量的輪蟲和藻類作爲泥鳅的開口餌料,而培養輪蟲也需要大量的藻類,上海光語生物科技有限公司的濃縮小球藻液具有純度高,濃度高,蛋白高的特點,采用全球頂尖的異養發酵技術,使得小球藻濃縮液的品質位居活餌産品前列。
國内某大型泥鳅養殖場以輪蟲爲餌料的泥鳅苗存活率高于僅僅以蛋黃爲飼料的實驗組,且以單獨添加輪蟲的清水實驗組成活率最高,但是以同時添加小球藻和蛋黃實驗組的泥鳅魚苗最爲壯碩、規格整齊。
但蛋黃與輪蟲混合投喂并添加了小球藻後,泥鳅魚苗的成活率大幅度提高,且個體明顯大于單獨投喂輪蟲的魚苗。由此可見蛋黃所富含的磷脂和膽固醇可以作爲泥鳅發育所需的營養,通過輪蟲濾食後傳遞給泥鳅魚苗,提高了輪蟲的營養價值;同時在培育水體中添加小球藻,既減少了蛋黃對水質的負面影響并穩定了水質,又起到強化輪蟲營養的作用。
因爲泥鳅魚苗遊動能力較弱,主動攝食能力不強,因此在投喂餌料的方法上還要注意以下幾個問題。
①投喂蛋黃時要均勻,并采用少量多次的方法,避免或減少下沉。
②盡量采用輪蟲與蛋黃搭配組合的方法投喂,充分利用輪蟲和蛋黃營養的互補性,減少了蛋黃惡化水質的可能性。
③少量補充單細胞藻類,利用藻類的光合作用增加水體溶氧并淨化水質,同時避免藻類濃度過高,影響泥鳅魚苗的正常發育。
④保持一定的充氣量,維持水中的溶解氧,促進有機物好氧分解,避免有機物厭氧分解産生有毒的中間物質和終産物,維持和改善水質。同時連續曝氣可以減少蛋黃等餌料下沉并使之分布均勻;但是充氣以微沸狀态爲宜,避免泥鳅魚苗逆水遊動而耗費體力。
由此可見,泥鳅養殖需要大量的輪蟲和小球藻,輪蟲的培養也需要大量的小球藻,穩定和優質的小球藻供應是泥鳅養殖的必須掌控的重要環節。
上海光語生物科技有限公司所采用的小球藻異養發酵技術,産能不受天氣影響,保證穩定供給,可以根據客戶需求定制小球藻的營養組成,同時可以根據用途不同,采用不同工藝将小球藻濃縮液做成投喂功能和肥水功能兩種規格。
實驗容器瓶高溫高壓滅菌前怎麽處理好
問:實驗容器瓶高溫高壓滅菌前怎麽處理好?瓶蓋要擰松吧?要用牛皮紙包着瓶蓋和瓶口嗎?或者錫箔紙
答:水不能太滿,一般到75%。蓋子擰到一半松緊即可。不需要再進行牛皮紙等包裹
問:滅那種磨砂的細口瓶呢?那種瓶蓋可能會因爲自身重力的原因沒法讓瓶口保持通氣啊
答:那就包上鋁箔吧,然後把瓶塞再用鋁箔單獨包裹
爲什麽有機玻璃(亞克力)管材闆材變黃
傳統的有機玻璃合成是以甲基丙烯酸甲酯爲原料經自由基引發(或離子型引發)聚合而成。引發劑通常爲偶氮二異丁腈或過氧化二苯甲酰,其聚合通式如下:
在本體聚合反應開始前,通常有一段誘導期,聚合速度爲零。在這段時間内,體系無粘度變化。然後聚合反應開始,單體轉化率逐步提高,當轉化率達到20﹪左右時,聚合速度明顯加快,稱爲自動加速現象。此時若控制不當,體系将發生暴聚而使産品性能變壞。轉化率達到80﹪之後,聚合速度顯著減低,最後幾乎停止反應,需要升高溫度來促使聚合反應的完全進行。 甲基丙烯酸甲脂聚合過程中出現的自動加速現象主要是由于聚合熱排除困難,體系局部過熱,有機玻璃會變黃。聚合過程中聚合熱的排除問題是本體聚合中最大的工藝問題。
水産中,100ppm次氯酸鈉溶液,需要多少硫代硫酸鈉中和?
1ml10%有效氯的次氯酸鈉溶液一般用0.25-0.3g硫代硫酸鈉(大蘇打)中和,溫度會有影響,中和時間不能少于2小時,混勻是必須的
工業純 化學純 分析純 色譜純 醫藥級 食品級
工業純、化學純、分析純和色譜純是按純度分級的,工業純的純度最低,色譜純的純度最高,分别用于工業生産、普通化學試驗、分析試驗以及色譜分析。
吸光光度測藻密度采用750的原因
吸光度測出來數據要求跟細胞密度有關,細胞在各個時期的葉綠素含量是不同的,細胞密度也是不同的,680測出來就亂了。
細胞樣品流式分析前期處理步驟
- 離心去除培養基,滅菌海水洗滌一次
- 加入1 mL的磷酸鹽緩沖液(1×PBS)重懸,再加入700 μL的70%乙醇,-80℃儲存備用
- 實驗前離心,加入70%乙醇反複洗滌去除色素至上清無色
- 向沉澱中加入1 mL的PBS洗滌去上清,再加入1 mL用PBS配置的0.3% Triton X-100,室溫下靜置40分鍾,離心,PBS洗滌,重懸,向重懸液中加入4 μL的RNase A,37℃水浴1小時,PBS洗滌,重懸,再加入10 μL的2.5 mg/mL碘化丙啶(PI)溶液,室溫遮光10分鍾
- FL3通道檢測DNA含量,激發光波波長520 nm,收集30,000個細胞,用MultiCycle軟件計算細胞處于G1,S,G2+M期的相對百分比,運行Win MDI 2.9軟件對實驗數據進行分析。
工業鹽、大鹽、海水直接曬幹的鹽、食用鹽的區别
工業鹽:工業鹽是在礦山開采出來的礦物鹽和化學合成的有鹽性質的化學原料,廣義的工業鹽指所有用于工業的鹽類,而氯化鈉隻是其中一種,爲了區别,常常把非食用的氯化鈉直接叫做工業鹽。
海水直接曬的鹽就是大鹽,經過粉碎洗滌以後,可以用于腌制,也就是市場上的粉洗鹽。以往的大顆粒海鹽也是食用鹽,由于不衛生已經不允許直接食用了,主要作爲工業鹽。經過過濾就是精鹽。
食用鹽:簡單說氯化鈉既可以食用,也可以工業用,隻是食用的有較高的衛生要求,還要加碘而已。至于海鹽、井礦鹽的區别是生産工藝和原料來源不同,主要成分都是氯化鈉,按食用鹽标準生産的就是食用鹽,按工業鹽标準生産的就是工業鹽。
我們平時商店裏買來的食鹽,都是經過嚴格加工制造的,可是在一些地方,常發現食用“粗鹽”,甚至食用工業用鹽中毒事件的發生。那麽,什麽是“粗鹽”?什麽是工業用鹽?它們與食用鹽有什麽不同呢?
“粗鹽”是指未精煉的海鹽,湖鹽或井鹽,主要由不法商販私自銷售的,有些人認爲散裝的大粒結晶的“粗鹽”,鹽分高,價格便宜,喜歡買來直接食用或用來腌菜等,因此,常常發生中毒,尤其在農村地區多見,有的稱爲“痺病”。
“粗鹽”中主要有毒成份爲氯化鋇,食用後進入人體,主要分布在肌肉中,它是一種肌肉毒,可使中毒人出現面部、四肢針刺樣發麻感,肌肉震顫、痙攣、抽搐 ;嚴重者肌肉逐漸癱瘓,瞳孔擴大而不能調節,舌肌麻痹發音困難;呼吸肌麻痹而出現呼吸困難者,随時可因心髒停搏和呼吸肌麻痹而死亡。
工業鹽并不是鹽,可在有些百姓的眼裏認爲工爲用鹽也是鹽,隻不過比食用鹽粗糙一些,有時誤将其放入炒菜、腌菜中,食入後發生中毒,工業鹽是一種化學物質——亞硝酸鈉,它除在化學工業應用外,在建築業上用作鋼筋的防鏽劑。因亞硝酸鈉有鹹味,無臭,外形極似食鹽、糖等,有些人還把它誤加入飲料、糕點中。
誤食“粗鹽”中毒後:
1、應立即催吐将鋇劑排出,洗胃前,口服硫酸鈉20-30g,并多飲水,使毒草物變爲一水溶性的硫酸鋇,再用2-5%的硫酸鈉液或溫水洗胃,直至澄清爲止。
2、洗胃後将琉酸鈉10-30g溶于200-300ml水中内服或灌入胃内,1小時後可重複應用。
3、嚴重者可用1%硫酸鈉10ml緩慢靜注,每隔30分1 次,直至症狀消失。也可用1-2%硫酸鈉注射液500-1000ml緩慢滴注,可連用2-3天。中毒較輕,可用硫酸鈉内服。如無硫酸鈉,可先用10-20%硫代硫酸鈉10-20ml靜注,再設法用硫酸鈉靜注。
4、注意補鉀,防治心律失常,營養心肌。
5、呼吸麻痹時,應立即進行人工呼吸,必要時作氣管插管或切開,給予呼吸中樞興奮劑。
服工業鹽中毒要比蔬菜等引起的亞硝酸鹽中毒嚴重,其表現和治療與其相同,請參考“食含亞硝酸鹽中毒及處理”。
如何防止在光合細菌培養過程中的綠藻污染問題
在光合細菌的培養過程中,經常會遇到污染綠藻的問題,很多培養戶爲此頭痛不已,可以肯定的是國内所有出售光合細菌培養基的廠家都有這個問題,綠藻的污染,使培養液變成綠色或綠色爲主的顔色,不僅使整批物料作廢,而且威脅下批物料培養的成功率。目前對此問題還沒有很好的解決方法,隻能有針對性地進行預防。
什麽是微分幹涉差顯微鏡(DIC顯微鏡)
1952年,Nomarski在相差顯微鏡原理的基礎上發明了微分幹涉差顯微鏡(differential interference contrast microscope)。DIC顯微鏡又稱Nomarski相差顯微鏡(Nomarki contrast microscope),其優點是能顯示結構的三維立體投影影像。與相差顯微鏡相比,其标本可略厚一點,折射率差别更大,故影像的立體感更強。
什麽是相差顯微鏡?
活細胞和未染色的生物标本,因細胞各部細微結構的折射率和厚度的不同,光波通過時,波長和振幅并不發生變化,僅相位發生變化(振幅差),這種振幅差人眼無法觀察。而相差顯微鏡通過改變這種相位差,并利用光的衍射和幹涉現象,把相差變爲振幅差來觀察活細胞和未染色的标本。相差顯微鏡和普通顯微鏡的區别是:用環狀光闌代替可變光闌, 用帶相闆的物鏡代替普通物鏡,并帶有一個合軸用的望遠鏡。
什麽是光生物反應器
光生物反應器是設計有光源系統的主體爲透明材料的生物反應培養設備,主要用于可進行光合作用的微藻、植物細胞、光合細菌的培養。
封閉式光反應器
敞開式培養系統
系統比較
什麽是 滅藻劑
滅藻劑 簡介
滅藻劑 在不同的PH值範圍内均有很好的殺菌滅藻能力,能有效地挖去藻類繁殖和粘泥增長,并有分散和滲透作用,能滲透并去除粘泥和剝離附着的藻類,此外,還有去油能力。 滅藻劑的主要成分: 十二烷基二甲基苄基氯化铵。
适用範圍
适用于各種水體 系統的藻類、微生物的殺滅如:魚塘、池塘、河道、大型中央空調、工程熱交換、制程等循環冷卻水 系統的處理。
特性
該藥劑屬于複合制劑具有廣普的殺菌能力,能有效的滲透細胞壁、分解細胞的DNA從而殺死并抑制其繁殖。本産品高效低毒,自然分 解周期短,環境介面友好、處理效能穩定。對高級水生動物基本無任何影響。是新一代廣泛推廣的環 保型水處理理想之殺菌滅藻藥劑.
物性外觀
| 項目 | 指标 | ​ |
| 外觀 | 無色或淡黃色透明液體 | 淡黃色蠟狀固體獲膠體 |
| 活性物含量% ≥ | 45 | 90 |
| 胺鹽含量% ≤ | 3.0 | 8.0 |
| PH值 | 6.0-8.0 | 6.0-8.0 |
使用方法
作非氧化性 滅藻劑 ,一般投加劑量爲50-100mg/L;作粘泥剝離劑,使用量爲200-300mg/L,需要時可投加适量有機矽類消泡劑。滅藻劑可與其它殺菌劑,例如異噻唑啉酮、戊二醛、二硫氰基甲烷等配合使用,可起到增效作用,但不能與氯酚類藥劑共同使用。投加1227後循環水中因剝離而出現污物,應及時濾除或撈出,以免泡沫消失後沉積。 。
殺菌滅藻劑的用途
包裝及貯存
滅藻劑采用塑料桶裝,貯存于室内通風陰涼處,避免陽光直射。
滅藻原理
滅藻劑與菌藻接觸後,快速斷開細菌和藻類蛋白質的鍵不可逆地抑制其生長、新陳代謝。從而導緻微生物菌藻的死亡,故對常見細菌、真菌、藻類等具有很強的抑制和殺滅作用。殺生效率高,降解性好,具有不産生殘留、操作安全、配伍性好、穩定性強、使用成本低等特點。殺滅藻類的同時并對對附着在管道壁上的生物粘泥有優異好的剝離效果。
光合細菌有哪些分類
藍細菌(Cyanobacter)
紫色細菌
如何培養硝化菌
提供夠大的表面積,硝化菌須要表面覆着.通常砂子跟生化棉或是陶瓷環都是一樣的作用,提供表面積。另外 需要充足水流流經,提供氧氣。這也就是爲什麽裸缸永遠不會像砂缸那樣穩定。裸缸中很難培養足夠的硝化菌,菌相很難達穩定
硝化菌培養還需要注意什麽
硝化菌是厭光的,所以開燈并不會增加硝化菌的培養。反而硝化菌喜好沒有光線的生長環境。
雖然硝化菌需要O2…但是CO2也是硝化菌不可或缺的化學能之一,如果沒有CO2硝化菌生長會受到抑制的,硝化菌除了會氧化亞硝酸(NO2)以及氨(NH3)取得它需要的能量之外…還需要碳原才能建構其個體以及提供能量。而NO2、O2以及NH3都沒有碳原…那怎麽提供呢?剛好硝化菌可以将CO2的C(碳)給分解出…并且C被取走了就剩下氧氣。所以CO2的地位與O2一樣相當重要喔!
消化菌比較正确的名稱爲 “異營菌。硝化菌并無法分解大便 主要由異營菌來分解大便。有人說硝化菌隻需2~3天就可以建立完成。剛好藉着這篇稍微說明一下。這是不可能的。如果這麽簡單就可以建立的話就不會顯得硝化菌的重要以及就不會有新缸症候群了,至於要花多久時間才能培養,一般是至少要四個禮拜
(按: 個人覺得如果适當的添加”有效的” 硝化菌種 可以快一點建立菌相 隻是2~3天 尚無法建立穩定菌相。)
觀賞水族中需要買光合菌嗎
光合菌主要用在水産養殖上,對于水族觀賞,隻要你缸内菌相完整 光合菌是不須要的,而且加了光合菌 他也隻能幫你作用個二三天 然後就會死掉,功用不太大,而且隻有短期作用
爲什麽買的液裝硝化菌沒什麽作用?
一分錢一分貨 我找了很多間水族館 發現現在液裝硝化菌超便宜,一大罐100ml 很大一罐 但上頭無生産日期 無保存日期,這樣子的東西 是不太可能會有用的 裏面大概都是些化學藥品居多吧。真正好的液裝硝化菌 會标期限 要在半年内使用
我買的硝化菌很臭 正常嗎?
如果你确定你買的是硝化菌 那你就是被騙了,真正的液裝硝化菌不會臭 因爲它們不靠有機物過活 液體不可能會臭。會臭的 大概裏面裝的是”消化菌” 硝化菌液應該呈現半透明 沒太多沉澱物 也不會臭的
在水産養殖中使用光合細菌有什麽好處?
水質惡化、魚病暴發,因爲水體缺氧導緻大量死魚的現象在各地水産養殖場可以說是非常常見;因爲大量投餌導緻水體變質引起鳝魚發病而不得不提前低價賣掉的現象可以說是年年屢見不鮮。養殖者渴求有一種能夠快速改善水質的神奇産品。
光合細菌對改善水質有着非常神奇的效果,将光合細菌潑灑入污染嚴重的池塘中,一般在3小時後,水質開始轉清,第二天去看,與周圍沒有潑灑光合細菌的池塘相比,水質有天壤之别,一看便知。若魚病很嚴重,每天均有死魚浮面的話,則用了光合細菌後,第二天去看,浮面的死魚顯著減少,直到消失,與周圍形成鮮明對比。
用了光合細菌,還可有效地幫助魚蝦安全越冬,冬季不但不減産,反而有增産。
用了光合細菌的水産品,顔色鮮豔,個體整齊,魚肉鮮嫩!
用光合細菌稀釋10倍後,對魚蝦進行藥浴,可使魚蝦成活率達到90%以上,發粘細菌病、爛鰓病、打印病、成活率達60-100%,水黴病、赤鳍病、擦傷病成活率達近100%,與其它化學藥物相比,更加安全可靠,無任何藥浴副作用。用了光合細菌一般畝産提高15-23%,餌料系數下降18-23%,成活率提高20-60%,個體增重提高15%,投入産出比達1:10以上。每畝可以增加效益達800元以上。
每年夏天缺氧死魚1萬多斤的水庫,去年按量潑灑光合細菌後,整個夏天僅出現不到100條死魚,而且基本沒有再開增氧機;各大養鳝區10月份就有大量養殖戶提前低價賣黃鳝,而我們在江蘇等地普遍潑灑光合細菌的養鳝戶中,卻沒有發現一戶有這樣的現象……
由于光合細菌系水劑,包裝、運輸成本高昂,一般市場售價高達每公斤5-8元。按規定用量使用一個夏天,一般每畝投入需要150-200元。一些養殖戶爲了節約開支,将每畝施用5公斤的常規用量降低到僅用1公斤,導緻淨化水質的效果大打折扣。
按照上海光語生物科技有限公司的培育方法加入菌種和水,即可在3-5天時間培養出大量的合格光合細菌菌液,産品符合國家相關标準(每毫升含光合細菌30億以上),每公斤光合細菌菌液的生産成本在0.3元以内。這樣,按規定标準進行使用,每畝每次也僅需花費1元多錢,一年潑灑6次也不到10元錢。
培育光合細菌需要哪些條件?
1、 營養條件
光合細菌細胞體構成元素主要有:碳、氫、氧、氮、磷、鉀、鈉、鎂、鈣、硫和一些微量元素等,它們也是所有生物細胞構成的主要物質。一般情況下,細胞鮮重:水占80%-90%、無機鹽1%-1.5%、蛋白質7%-10%、脂肪1%-2%、糖類和其它有機物1%-1.5%。其中幹細胞含碳45%-55%、氫5%-10%、氧20%-30%、氮5%-13%、磷3%-5%、其它礦物元素3%-5%。光合細菌的細胞壁具有半透性,能選擇性地讓一些營養元素按一定比例進入,在酶的作用下合成自己的細胞組織和裂變的新個體。
營養元素的全面和搭配的合理,是營養條件的關鍵。根據這一要求,選用多種無基原料,科學配方,經特殊加工而成的”光合細菌培養基”,基本符合光合細菌生長繁殖所需的營養要求,無毒無副作用,使用安全,固狀結晶體便于包裝和運輸,而且有2年的保質期。用其生産菌液(每毫升含有30-50億個活菌體),每公斤成本不到0.3元,且現制現用,質量明顯優于市場出售的同類産品。
光合細菌培養基,是光合細菌生長繁殖所需各種營養元素的組合體。每種原料都能得以充分利用,最大限度地生産高濃度的菌液,因此,單位效價的光合細菌菌液生産成本低、質量好,這無論是對于用戶、經銷商還是廠家都有很大的益處,對在工農業生産中的推廣和普及将産生深遠的影響。
2.環境條件
有了營養全面的光合細菌培養基,隻是給光合細菌提供了“食物”,還需要有适宜光合細菌生長的環境條件,才能培養出優質的菌液。環境條件具體有以下幾個方面:
(1)培養介質:含菌量較低的清潔淡水、海水或加粗食鹽的淡水。從經濟、實用的角度考慮,地下水含菌量低,爲最佳水源;清潔的地表水也可使用;含氯量較高的自來水應敞口放置兩三天或調PH值至偏堿後使用;蒸餾水及純淨水固然很好,但成本太高,可用于提純菌種。
(2)酸堿度(PH)值:7.5-8.5最佳(适應範圍6-10)。
(3)水硬度:PH值中性時10度以下。即調節PH值至8.0左右時,培養介質中的乳白色沉澱物不宜過多。
(4)溫度:25℃-34℃最佳(适應範圍15℃-40℃)。
(5)光照度:3000LX-4000LX最佳。即每25千克菌液需用60瓦左右的電燈泡進行光照,當然,太陽光最好且無需成本。
(6)透氣性:密閉、敞口皆可培養,密閉效果更好。
(7)容器:透明或白色容器;大規模培養可用土池、水泥池等,菌液深度30厘米以下爲佳。
光合細菌有什麽作用?
光合細菌生命力、适應性都很強,在生長繁殖過程中能分解有機物和吸收水體中的氨态氮、硫化氫、亞硝酸鹽等有害物質,本身無毒無污染。它在光照厭氧條件下生長旺盛,在無光黑暗通氣條件下亦能生長,但不合成紅色素,易經誘導産生廣泛的适應酶,對降解某些有毒或人工合成化合物具有潛力;耐低溫(即使冰凍也不會死亡)和高鹽度(20%),适合處理高濃度有機廢水,是優良的水環境改良劑。
光合細菌菌體營養豐富,含蛋白質(60%以上),維生素B12、葉酸、核黃素、類胡羅蔔素、輔酶Q10等促長因子和生理活性物質,是優良的飼料添加劑。
光合細菌以土壤接受的光和熱爲能源,将有機和無機營養物質轉化成易爲植物吸收的小分子物質。同時光合細菌除本身的有機營養物質外,還含有銅、鋅、钼、钴、鎳等微量元素,含量适中,施用後,可補充土壤所缺,提高肥效,是優良的植物肥料。
光合細菌應用
(1)養殖業
我國是養殖大國,近年來,養殖業取得了很大的發展。但是,傳統的水産和畜禽養殖成本高,産量小,效益低,特别是養殖中使用的各種消毒劑和抗生素,即破壞養殖環境,污染水産品,又增加養殖成本。如何有效地克服上述缺點呢?光合細菌作爲優良的水環境改良劑和飼料添加劑,用于養殖業在我國才是近幾年的事,由于最早使用光合細菌的用戶,取得了很好的效果和較大的經濟效益,因此目前倍受推崇,大有普及之勢。那麽,光合細菌究竟起到什麽樣的作用呢?
① 淨化水質
由于高密度水産養殖的水體中,含有大量的魚類糞便和殘餌,以及魚藥的殘留物,它們腐敗後産生的有害物質直接污染水體和底泥。輕度污染可造成魚類生活不适,飼料系數增高,生長緩慢,免疫力下降;積累到一定程度後,能使魚類中毒、發病甚至死亡。這是由于有害物質,除直接危害魚類外,同時也是病原微生物的營養源,并使之大量繁殖,使魚類感染發病。兼性厭氧的光合細菌能改善水質的主要原因,是它在分解有機質時不産生有害物質,并且還能利用有害物質作爲營養源,長成自已的有益細胞,變害爲寶;形成優勢群落後,還能競争性地抑制病原微生物的生長,降低感染機率。從而淨化水質使魚類健康生長。
② 維持微生态平衡
養殖的水體中存在着各種各樣的微生物,有的是有益的;有的是有害的;有的處于中間狀态,叫”條件緻病微生物”,即正常情況下,這類微生物不緻病,但在水質惡化,魚類免疫力下降時,便大量繁殖危害魚類。自然界中,有害微生物和條件緻病微生物都叫”病原微生物”是不可排除的,廣義上講,它們有利于生物進化。它們能使一些不健康的、免疫力低或退化了的生物體被淘汰。但是,無論是有害微生物還是條件緻病微生物,必須在水體中達到一定濃度才能危害魚類,這個濃度叫”發病臨界點”。不同種或不同體質的魚,發病臨界點不一定相同。在漁業生産中,控制病原微生物的濃度,使其達不到發病臨界點,是健康養殖的關鍵。通常人們采用消毒殺菌劑來控制,但随着施用次數的增加,病原微生物的耐藥性亦相應增強,爲了達到預防效果,施用劑量逐步加大,這不僅增加了用藥成本,還污染了水體,造成水産品品質下降,甚至不能食用。同時魚類易産生應激反應,停食、消瘦,浪費有限的生長期。到了魚類發病需要治療的時候,安全劑量治不了病,大劑量施用又容易對魚類産生危害,這個矛盾制約了水産業的發展。
如何控制病原微生物的生長繁殖,并使其不産生耐藥性呢?光合細菌可基本克服消毒殺菌劑的缺點,它通過降解或清除水體中包括魚藥在内的有害化學物質;與病原微生物争奪營養、空間,使其無法大量繁殖,從而不易形成緻病的環境條件。假如由于病原微生物的原因,魚類發了病,說明它在水體中的濃度已達到或超過發病臨界點,在微生物群體中占優勢,此時,再用光合細菌治療是沒有明顯效果的.須用消毒殺菌劑治療,6-7天後,再施用光合細菌保養水質。
魚類病害防治原則是:防重于治。隻有在日常漁業生産中,維持水體微生态平衡,使有益微生物始終占絕對優勢,才是健康養殖的出路。如果平時不有效地預防,到了出現症狀時再去治療,那麽,包括魚藥成本在内的重大損失将是不可避免的。
③ 培養浮遊動物作餌料
光合細菌營養豐富,這正是浮遊動物的優質餌料。實踐證明,水體中光合細菌越多,浮遊動物生長繁殖越旺盛,以浮遊動物爲食的魚類增産效果也就越明顯,如蝦、蟹、花鲢、河蚌等。浮遊動物作爲仔魚、糠蝦、貝苗等開口餌料,營養價值高,易于消化吸收。此外,光合細菌對于剛孵化後,還不能主動捕食的仔魚是最适宜的餌料,此時仔魚的消化系統各器官尚未完全分化,光合細菌通過鰓被吸入體内,在卵囊尚未被完全吸收的同時,即可從外界攝取營養,以彌補内源性營養的不足,從而大大提高成活率。
④ 間接增氧
光合細菌分解有機質進行生長繁殖時,不需要氧氣,也不釋放氧氣,它節約了好氧微生物分解有機質時所需的氧,産生間接增氧作用。
⑤ 飼料添加劑
在相對營養不良的情況下,養殖動物的免疫力下降,有害菌得以發展,容易出現疾病症狀。一般情況下,配合飼料中的活性營養成份較少,飼料系數較高。光合細菌作爲優良的飼料添加劑,含有大量的促長因子和生理活性物質,營養豐富,拌和飼料後,可補充和增加飼料營養成份、降低飼料系數;刺激動物免疫系統,促進胃腸道内的有益菌生長繁殖,增強消化和抗病能力,促進生長。
(2)種植業
光合細菌肯有很強的固氮能力,能夠改善土壤的營養結構,肥沃土壤,可作爲基肥、追肥。光全細菌在土壤中大量生長繁殖,有利于土壤中有效力微生物(如放射線菌)的生長,減少有害菌群(如絲狀真菌)引起的病害。
光合細菌在農作物上使用,用于水稻和小麥,有利于根系發育,提高有效分蘖和成穗數,用于蔬菜及花卉等,可提高産量和品質,延長保鮮期;用于浸泡種子,發芽率高、生長速度快、抗病力強。對棉花的枯黃、草莓的根腐病等防治效果顯著。
(3)環保業
生物學污水處理法是指通過微生物酶的作用,分解和合成有機質。其中起主要作用的是細菌,污水中一些可溶性的有機物在胞内酶的作用下被菌體選擇性地吸收;顆粒、膠體等難溶或不溶性的有機物先附着在菌體外,由菌細胞分泌的胞外酶分解成脂溶性和水溶性物質,再被菌體吸收。通過微生物體内的生化作用,将一部分有機物同化成自身,另一部分被異化成水分子有機物、二氧化碳、水等,從而使污染物質得到降解。
光合細菌兼性厭氧的特性和很強的适應性,使其在污水發酵處理中,作用日益突出。例如光合細菌(莢膜紅假單胞菌)可将緻癌物亞硝胺轉化爲無毒的化合物,對于生化需氧量(BOD)高達數千mg/L的有機廢水,一些生物膜法及活性污泥法等需氧處理法難以耐受,而光合細菌則可以承受,故在處理高濃度有機廢水方面具有廣泛的應用前景。
什麽是微藻能源
藻類是最低等、最古老的一類植物。雖說結構簡單,它卻能産出一種生物“原油”,這種生物“原油”相當于石油的原油,可用來提煉汽油、柴油、航空燃油,以及作爲塑料制品和藥物的原料。同時,多數藻類植物還能制造出大量的碳水化合物等中間産品,這些産品經過發酵處理可以轉化爲乙醇燃料。可以說,藻類植物與生物燃料“緣分”很多。
二次世界大戰期間,美國有個著名的、研制原子彈的“曼哈頓計劃”。如今,美國又出了個“微型曼哈頓計劃”,不過,它的宗旨不是研制原子彈,而是向藻類植物要油,以幫助美國擺脫嚴重依賴進口油的能源窘境。 不僅如此,這一計劃更令人矚目的是,它重新燃起了美國新一輪的藻類生物“原油”研發熱潮。
藻類産生能源 同時解決氣候問題
近日,由沈陽院承擔的“新型能源藻培養與能源産品轉化技術”項目啓動暨工作交流會在沈陽召開,主要是開發能源藻類大規模培養和藻基生物能源産品制備技術,對推進我國能源多元化進程,緩解氣候環境保護壓力,保障我國能源安全和社會可持續發展均具有重大意義,該項目是“863計劃”先進能源技術領域的重點項目之一。
“新型能源藻培養與能源産品轉化技術”項目,将包括能源藻類大規模培養技術和藻基生物能源産品制備技術的開發。該項目包含3個子課題,分别爲“富油能源微藻培育與生物柴油制備”、“藻類航空煤油制備技術”和“基于能源藻原料的生物能源産品的制備技術”,其中沈陽院作爲項目牽頭單位,承擔了“富油能源微藻培育與生物柴油制備”子課題。
上海光語生物科技有限公司提供的光生物反應器,可以爲客戶提供合适的反應培養容器用來篩選合适的藻種和進行有效的營養分析。
新的水族缸裏的水看起來一直霧霧的,換了水還是會霧?
因爲缸子中菌相尚未建立 消化菌及硝化菌都尚未存在 換再多水 還是會起霧的感覺。建議先設好缸子 讓水動幾天後 再放入魚隻 初期喂食量不要太多 讓菌種微生态系統慢慢穩定!
什麽是硝化菌
都是叫 消硝 但和消化菌大大的不同
也是很多人會搞錯的地方
硝化菌 也是一大群細菌的總稱
爲好氧性菌
無法分解有機物 也就是無法分解大便或是飼料
而是将水中的氨或亞硝酸分解 ( 分解爲較無毒的物質 )
通常這二種物質就是水中的有毒物質
也是水聞起來有腥味或臭味的因素
什麽是EM菌
EM菌(Effective Microorganisms)是由大約80種微生物組成, EM菌由日本琉球大學的比嘉照教授1968年研究成功,于80年代投入市場。 EM菌是 以光 合細 菌、乳酸 菌、酵母 菌 和放 線菌 爲主 的 6 個屬 56餘個微生物複合而成的一 種微生 活菌 制劑。作用機 理是形成EM菌和 病原 微生物 争奪營 養的競争,由于em菌在土壤 中極易生 存繁 殖,所以能較快 而 穩 定地占 據土 壤 中的生态地 位,形成有 益的微生 物菌的優勢群落,從 而 控制病 原 微生物的 繁 殖和 對作 物 的侵襲。80年代末90年代初,EM菌 已被 日本、泰 國、巴 西、美 國、印度尼西 亞、斯裏 蘭卡 等 國廣 泛應 用幹農 業、環 保等領域,取得了 明顯的經濟效益 和生态效益。
EM = Effective Microorganism (有益微生物群)
是由光合菌群、乳酸菌群、酵母菌群、革蘭氏陽性放線菌群、發酵系的絲狀菌群共五科10屬80多種有益菌共生共榮組成的新型微生物制劑。它的發明人是日本琉球大學比嘉照夫教授。EM原露技術自1991年引入中國,經證明其适用于農作物種植業、畜禽飼養業、水産養殖業、環保業和人體保健。
What is “EM”?
This exception is “EM”, standing for “effective microorganisms”. EM products were developed by T. Higa of Ryukyu University, Okinawa. They contain abundant anaerobic lactic acid bacteria and yeasts, as well as other microorganisms. The utilization of these anaerobic microorganisms is a distinctive feature which distinguishes EM from other microbial products. EM first attracted notice in garbage treatment by local governments that were struggling to cope with the increasing amount of garbage. The EM manufacturer claimed that individual households could make “compost” of good quality in one or two weeks using a sealed plastic bag or container containing cooking refuse mixed with an EM product. Although anaerobic fermentation usually generates an unpleasant odor, EM products were claimed to suppress any bad smells by producing lactic acid. Higa claimed that the “compost” thus prepared could be used in a home garden or distributed to farmers. This idea attracted local governments, who hoped it would cut down on the cost of garbage treatment, as well as citizens who appreciated the importance of recycling. The “compost” thus prepared, however, has a very high water content, because water vapor cannot escape from a sealed bag. It also contains a large amount of available organic matter, because the decomposition of organic matter is incomplete, as with the making of silage or pickles. Incorporating available organic matter into the soil causes an explosive proliferation of pathogenic “sugar fungi” such as Physium and Rhizoctonia. Therefore, many crop failures have occurred when seeds were sown just after application of the “compost”. Some farmers’ groups are now making bokashi from this garbage compost by drying it, mixing it with other materials, and composting this mixture further.
1、光合菌群(好氣性和嫌氣性)。如光合細菌和藍藻類。屬于獨立營養微生物 ,菌體本身含60%以上的蛋白質,且富含多種維生素,還含有輔酶Q10、抗病毒物質和促生長因子;它以土壤接受的光和熱爲能源,将土壤中的硫氫和碳氫化合物中的氫分離出來,變有害物質爲無害物質,并以植物根部的分泌物、土壤中的有機物、有害氣體(硫化氫等)及二氧化碳、氮等爲基質,合成糖類、氨基酸類、維生素類、氮素化合物、抗病毒物質和生理活性物質等,是肥沃土壤和促進動植物生長的主要力量。光合菌群的代謝物質可以被植物直接吸收,還可以成爲其它微生物繁殖的養分。光合細菌如果增殖,其它的有益微生物也會增殖。例如:VA菌根菌以光合菌分泌的氨基酸爲食餌 ,它既能溶解不溶性磷,又能與固氮菌共生,使其固氮能力成倍提高。
2、乳酸菌群(嫌氣性)。以嗜酸乳杆菌爲主導。它靠攝取光合細菌、酵母菌産生的糖類形成乳酸。乳酸具有很強的殺菌能力,能有效抑制有害微生物的活動和有機物的急劇腐敗分解。乳酸菌能夠分解在常态下不易分解的木質素和纖維素,并使有機物發酵分解。乳酸菌還能夠抑制連作障礙産生的緻病菌增殖。緻病菌活躍,有害線蟲會急劇增加,植物就會衰弱,乳酸菌抑制了緻病菌,有害線蟲便會逐漸消失。
3、酵母菌群(好氣性)。它利用植物根部産生的分泌物、光合菌合成的氨基酸、糖類及其它有機物質産生發酵力,合成促進根系生長及細胞分裂的活性化物質。酵母菌在EM原露中對于促進其它有效微生物(如乳酸菌、放線菌)增殖所需要的基質(食物)提供重要的給養保障。此外,酵母菌産生的單細胞蛋白是動物不可缺少的養分。
4、放線菌群(好氣性)。
5、發酵系的絲狀菌群(嫌氣性)。
如何找到合适的藻類培養容器

目前情況下藻類培養普遍使用5L的錐形瓶,放在恒溫箱或者光照控制箱裏面。如果在使用營養分析和生長環境試驗就會使得各個容器的環境不是嚴格意義上的一緻。如果用在養殖生産上,連續培養也找不到合适的容器。
上海光語生物科技有限公司爲客戶提供标準的60L連續培養光生物反應培養器,具有攪拌,充氣,測溫,測光照,自動控溫,控制光照的功能。歡迎客戶來電咨詢。可培養實驗或者生産使用的光合細菌,海水藻,淡水藻等,滿足自動化培養和采摘濃度标準化控制。
什麽是光合細菌
光合細菌爲自營菌 也是一大群細菌的總稱 , 爲厭氧性菌 能在光線充足的地方自行光合作用,能幫助分解水中有機物質
不過因爲他是厭氧性菌 在大自然中通常存在泥土或氧氣少的地方 ,在養殖水體中無法長期存在 添加後幾天内就會失去效用,因此必須定期再添加 ,不屬於水族箱中長存的菌種
光合細菌,消化細菌,硝化細菌這三個細菌都是不同的菌,水族箱中以前二者較爲重要,也關系者水族箱中菌相平衡的一大因素
英文名: Photosynthetic Bacteria (Abbr. name: PSB )光合細菌(簡稱PSB)是地球上出現最早、自然界中普遍存在、具有原始光能合成體系的原核生物,是在厭氧條件下進行不放氧光合作用的細菌的總稱,是一類沒有形成芽孢能力的革蘭氏陰性菌,是一類以光作爲能源、能在厭氧光照或好氧黑暗條件下利用自然界中的有機物、硫化物、氨等作爲供氫體兼碳源進行光合作用的微生物。光合細菌廣泛分布于自然界的土壤、水田、沼澤、湖泊、江海等處,主要分布于水生環境中光線能透射到的缺氧區。
光合細菌在有光照缺氧的環境中能進行光合作用,利用光能進行光合作用,利用光能同化二氧化碳,與綠色植物不同的是,它們的光合作用是不産氧的。光合細菌細胞内隻有一個光系統,即PSI,光合作用的原始供氫體不是水,而是H2S (或一些有機物),這樣它進行光合作用的結果是産生了H2,分解有機物,同時還能固定空氣的分子氮生氨。光合細菌在自身的同化代謝過程中,又完成了産氫、固氮、分解有機物三個自然界物質循環中極爲重要的化學過程。這些獨特的生理特性使它們在生态系統中的地位顯得極爲重要。
在水産養殖中運用的光合細菌主要是光能異養型紅螺菌科(Rhodospirillaceae)中的一些品種,例如沼澤紅假單胞菌(Rhodop seudanonas palustris);
在自然界淡、海水中通常每毫升含有近百個PSB菌,光合細菌的菌體以有機酸、氨基酸、氨和醣類等有機物和硫化氫作爲供氧體,通過光合磷酸化獲得能量,在水中光照條件下可直接利用降解有機質和硫化氫并使自身得以增殖,同進淨化了水體。
除此之外,細胞内還含有碳素儲存物質糖原和聚β一羟基丁酸、輔酶Q、抗病毒物質和生長促進因子,具有很高的飼料價值,在養殖業上有廣闊的應用前景。 PSB在厭氧光照條件下,能利用低級脂肪酸、多種二羧酸、醇類、糖類、芳香族化合物等低分子有機物作爲光合作用的電子受體,進行光能異養生長。在黑暗條件下能利用有機物作爲呼吸基質進行好氧或異養生長。光合細菌不僅能在厭氧光照下利用光能同化CO2,而且還能在某些條件下進行固氮作用和在固氮酶作用下産氫。另外,有些菌種在黑暗厭氧條件下經丙酮酸代謝系統作用也可産氫。光合細菌還能利用許多有機物質如有機酸。醇、糖類轉化某些有毒物質如 H2S和某些芳香族化合物等。 PSB通過生物轉化,可合成無毒、無副作用且富含各類營養物質的菌體蛋白,不僅改善了生态環境,還爲養殖業提供了高質量的飼料原料。 PSB菌體中對動物生長有促進作用的維生素B12、生物素、泛酸、類胡蘿蔔素、葉綠素以及與造血、血紅蛋白形成有關的葉酸的含量遠高于一般微生物,尤其含有人工不能合成的生物素D一異構體。這些物質在動物機體内都具有顯著生理活性 在水産養殖中,養殖池按水中溶解氧含量的大小由表層向底部可分爲好氧區和厭氧區。表層生物繁殖旺盛,水質一般較好;底層則積累了魚蝦的排洩物和未消耗盡的食物殘料,有機質豐富,造成微生物的大量繁殖,消耗了水中大量的氧氣,導緻地底層形成無氧環境,硫酸鹽還原菌大量繁殖,産生對魚蝦有毒害作用的硫化氫、酸性物質等。養殖地底層的這種環境正好是适于光合細菌生存的條件一是具有厭氧條件,二是光線通過上面覆蓋的有氧水層這個光線過濾器,使光合細菌可以吸收到适宜生長的450-550μm波長光。光合細菌利用地底的魚蝦排洩物、食物殘料以及有毒有害的硫化氫、酸性物質作爲基質大量繁殖,提高水體中溶解氧含量,調節pH,并使氨氮。亞硝酸态氮、硝酸态氮含量降低,池底淤泥蓄積量減少,有益于藻類和微型生物數量的增加,使水體得以淨化。 PSB可進行光合成、有氧呼吸、固氮、固碳等生理機能,且富含蛋白質、維生素、促生長因子、免疫因子等營養成分,在功能上可與抗生素相媲美,并且更具有安全性,是生物工程具有前景的研究領域之一。光合細菌制劑還具有獨特的抗病、促生長功能,大大提高了生産性能,在應用方面顯示了越來越巨大的潛力。其它在淨化水質、魚蝦養殖、畜禽飼養、有機肥料及新能源的開發方面有着廣闊的應用前景。